Abstract
The ex vitro acclimatization and greenhouse periods play a significant role for the in vitro originated plantlets. In these stages, the micropropagated plantlets have to rapidly adapt to environmental changes. Rhynchostylis gigantea is widely in vitro produced due to highly aesthetic and economic value. The aim of this work was to update the physiological changes of micropropagated R. gigantea plantlets during ex vitro acclimatization and greenhouse stages. The analysis results showed that leaf water content was significantly decreased at day 14 (90.36%) and day 28 (90.17%) stages but increased at day 84 (92.52%) and day 140 (92.34%) stages in compared to in vitro stages, day 0 (92.7%). Dry matter content was changing in the opposite direction to the leaf water content with the highest values at day 14 (9.63%) and day 28 (9.83%), respectively. The leaf transpiration rate was the highest at day zero (0.146 g/dm2/h) in compared to all other studied points. Oppositively, GPX activity was the lowest in plantlets at day zero (13.2 UI/g fresh leaf ) and the highest in planlets at day 14 (36,4 UI/g fresh leaf ). The leaf proline content was higher at day 7 and day 14 stages (132.3 and 150.8 m g/g fresh leaf, respectively) but lower at day 84 and day 140 stages (44.3 and 53.3 microgram/g fresh leaf, respectively) than at day zero (73.7 microgram/g fresh leaf ).
MỞ ĐẦU
Lan Đai châu hay lan Ngọc điễm, Nghinh Xuân có tên khoa học là Rhynchostylis gigantea thuộc chi Rhynchostylis , họ Phong lan (Orchidaceae). Loài lan này có hoa đẹp, phù hợp với mục tiêu trang trí, được ưa chuộng và có giá trị kinh tế cao. Do đó, một số nghiên cứu nhân giống in vitro lan Đai châu đã được thực hiện để đáp ứng được nhu cầu của con người với số lượng lớn 1 , 2 , 3 .
Giai đoạn luyện ex vitro giữ vai trò rất quan trọng đối với công nghệ nhân giống in vitro các loại cây trồng. Trong quá trình này, cây con phải thích nghi với sự thay đổi của môi trường sống từ nhân tạo (giàu đường, phytohormone và có độ ẩm cao) đến tự nhiên trong một thời gian ngắn 4 . Vì vậy, nhiều nghiên cứu về các biến đổi sinh lí hóa sinh trong giai đoạn luyện cây ex vitro ở một số loài thực vật đã được tiến hành như ở cây táo 5 , cây dâu tằm ( Morus nigra L.) 6 , cây Etlingera elatior 7 , lan Hoàng thảo ( Dendrobium ) 8 , cỏ ngọt ( Stevia rebaudiana ) 9 . Nhiều biến đổi về sinh lý, hóa sinh rất đáng chú ý giúp thực vật có thể thích nghi với môi trường mới đã được nghiên cứu, trong đó có hoạt độ một số enzyme chống oxi hóa cũng như các chất bảo vệ thẩm thấu. Các enzyme peroxidase (POX), superoxide dismutase (SOD), catalase được quan tâm do có vai trò loại bỏ các gốc oxi hóa tự do cũng như H 2 O 2 trong mô thực vật, giúp bảo vệ thực vật chống lại các stress bất lợi của môi trường 10 . Hoạt độ SOD tăng mạnh sau bảy ngày luyện cây, nhưng giảm xuống ở cuối quá trình luyện ex vitro , trong khi đó, hoạt độ catalase và ascorbate peroxidase (APX) tăng dần trong suốt quá trình luyện cây ex vitro ở cây Tam phỏng 11 . Hoạt độ của các enzyme trên của cây Đầu đài Ấn Độ ( Tylophora indica ) đều tăng trong thời kì luyện ex vitro so với cây in vitro 12 . So với ở cây cỏ ngọt in vitro , hoạt độ guaiacol peroxidase (GPX) tăng cao trong cây ở giai đoạn 2, 7, 14 và 21 ngày nhưng giảm về mức ban đầu ở ngày 28 của quá trình luyện ex vitro 9 . Bên cạnh đó, proline, một chất bảo vệ thẩm thấu, giúp cây chống lại stress cũng được nghiên cứu ở cây in vitro trong giai đoạn luyện ex vitro 13 , 14 . Trong nghiên cứu gần đây của chúng tôi, những biến đổi về hàm lượng sắc tố quang hợp, huỳnh quang diệp lục cũng như hoạt độ catalase của cây lan Đai châu in vitro trong thời gian sớm (đến thời điểm 28 ngày) của quá trình luyện cây đã được báo cáo 15 . Mục tiêu của bài báo này là nghiên cứu một số biến đổi của một số đặc điểm sinh lí, hóa sinh của cây lan Đai châu có nguồn gốc in vitro trong thời kì luyện cây ex vitro và thời kì cây non trong nhà lưới gồm các biến đổi về hàm lượng nước, chất khô, cường độ thoát hơi nước, hàm lượng proline và hoạt độ POX. Các chỉ tiêu này có ý nghĩa lớn đối với sự trao đổi nước, khả năng giữ nước và hoạt động phân giải H 2 O 2 vốn có ảnh hưởng lớn tới khả năng tồn tại cũng như sinh trưởng, phát triển của cây in vitro trong thời kỳ luyện ex vitro và ở nhà lưới. Những kết quả nghiên cứu về một số biến đổi sinh lí, hóa sinh này có ý nghĩa lớn, cung cấp các thông tin khoa học bổ ích, làm sáng tỏ cơ sở của biện pháp kĩ thuật để luyện cây ex vitro .
VẬT LIỆU VÀ PHƯƠNG PHÁP
Vật liệu nghiên cứu
Cây phong lan Đai châu in vitro có rễ được nuôi cấy trên môi trường MS 16 có bổ sung 30 g/L đường sucrose, 2 g/L than hoạt tính, 6 g/L agar (hãng sản xuất Qualigens, Mumbai, India). Mười bình cây (5 cây/bình) được đặt trong phòng nuôi cây với điều kiện nhiệt độ 25°C/22°C (ngày/đêm), chu kì 12 h sáng/12 h tối, chiếu sáng với đèn huỳnh quang (hãng Rạng Đông, Việt Nam, cường độ ánh sáng khoảng 1920 – 1990 lux). Cây có 2-3 lá được sử dụng cho quá trình luyện ex vitro . Bình chứa cây được cho tiếp xúc với ánh sáng tự nhiên 7 ngày bằng cách đặt trong nhà lưới, sau đó agar được loại bỏ, ngâm cây 5 phút trong dung dịch KMnO 4 0,1%, đặt trên bề mặt thoáng (có khay chứa nước ở dưới) trong thời gian 7 ngày kế tiếp, phun sương hai lần/ngày, sau đó cây được trồng trong chậu nhựa (đường kính 10 cm) có giá thể là hỗn hợp rêu và than sinh học (tỷ lệ 1:1), đặt trong nhà lưới tại Khoa Khoa học Tự nhiên, Trường Đại học Hùng Vương, thời gian nghiên cứu từ tháng 3/2016 đến tháng 9/2016. Các mẫu lá được thu vào các thời điểm: cây in vitro trước khi chuyển ra tiếp xúc với ánh sáng tự nhiên (ngày 0), cây in vitro đã tiếp xúc với ánh sáng tự nhiên 7 ngày (ngày 7), cây ex vitro được cho ra khỏi bình và đặt trên bề mặt thoáng 7 ngày (ngày 14), cây được trồng trên giá thể sau 28, 84 và 140 ngày tính từ ngày 0 (ngày 28, ngày 84 và ngày 140).
Phương pháp nghiên cứu
Ba lá của ba cây khác nhau (một lá/cây) được thu ngẫu nhiên để thực hiện các phân tích sinh lí, hóa sinh. Cây lan tươi được cân bằng cân kĩ thuật (Pioneer TM, Ohaus Corp., Mỹ), sau đó sấy khô đến khối lượng không đổi ở 80 o C, cân khối lượng khô. Hàm lượng nước, hàm lượng chất khô được tính trên cơ sở khối lượng tươi và khối lượng khô của mẫu nghiên cứu 17 . Cường độ thoát hơi nước được xác định bằng phương pháp cân nhanh 17 . Hàm lượng proline được xác định theo phương pháp quang học theo Bates và cs (1973) 18 . 0,2 g lá tươi mỗi mẫu được nghiền với 5 mL sulfosalicylic acid 3%, li tâm tốc độ 10000 vòng/phút ở 4 o C trong 20 phút, 2 mL dịch nổi sau li tâm được cho phản ứng với 2 mL ninhydrin và 2 mL acid acetic, ủ trong nước nóng 100 o C trong 60 phút sau đó ủ trong nước đá 5 phút. Bổ sung vào ống nghiệm phản ứng 4 mL toluen, lắc đều, lấy phần dịch nổi màu hồng và đo giá trị mật độ quang (OD) ở bước sóng 520 nm. Hàm lượng proline được xác định dựa vào đường chuẩn 17 . Hoạt độ GPX được xác định bằng phương pháp quang phổ với cơ chất phản ứng là guaiacol theo Fielding and Hall (1978) 19 . 0,4 g lá tươi mỗi mẫu được nghiền trong 1 mL đệm phosphate 0,1 M pH 7. Li tâm ở tốc độ 10000 vòng/phút ở 4 o C trong 10 phút. 0,1 mL dịch li tâm được chuyển sang ống phản ứng, bổ sung 3 mL dung dịch đệm phosphate 0,1 M pH 7, 0,05 mL dung dịch guaiacol và 0,03 mL dung dịch H 2 O 2 12,3 mM, đo giá trị OD ở 430 nm 17 . Các chỉ tiêu phân tích ở mỗi thời điểm gồm ba mẫu được thu ngẫu nhiên. Các giá trị trung bình, độ lệch chuẩn (SD), và sự khác biệt giữa các giá trị trung bình được kiểm định bằng phép kiểm tra Duncan (p=0,05) bằng phần mềm SPSS.
KẾT QUẢ VÀ THẢO LUẬN
Hàm lượng nước, chất khô
Figure 1 . Hàm lượng nước trong lá phong lan Đai châu thời kì luyện ex vitro và trong nhà lưới. Thanh sai số thể hiện giá trị độ lệch chuẩn. Các thanh sai số được đánh dấu cùng chữ cái không khác nhau có ý nghĩa thống kê (p=0,05) khi kiểm định với phép kiểm tra Duncan.
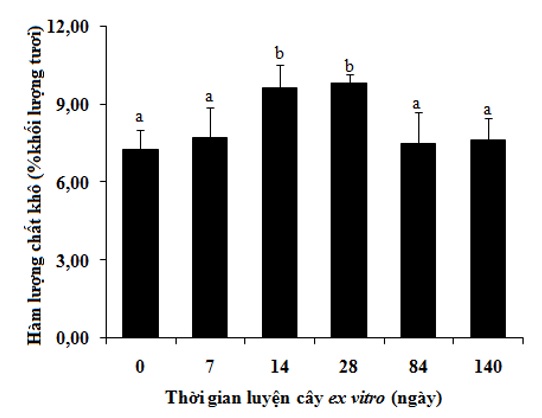
Figure 2 . Hàm lượng chất khô trong lá phong lan Đai châu thời kì luyện ex vitro và trong nhà lưới. Thanh sai số thể hiện giá trị độ lệch chuẩn. Các thanh sai số được đánh dấu cùng chữ cái không khác nhau có ý nghĩa thống kê (p=0,05) khi kiểm định với phép kiểm tra Duncan.
Khi chuyển cây in vitro ra khỏi bình nuôi cây trong quá trình luyện cây ex vitro , độ ẩm không khí là một trong những điều kiện sống thay đổi rõ nét nhất, từ thường ở mức gần bão hòa hoặc bão hòa trong môi trường in vitro giảm xuống khoảng 70 – 80% ở không khí bên ngoài. Khi chuyển cây từ in vitro sang ex vitro , sự giảm hàm lượng nước trong mô cây táo 5 hoặc cây riềng đã được báo cáo 20 .
Khi nghiên cứu hàm lượng nước trong cây phong lan Đai châu trong và sau quá trình luyện cây ex vitro , chúng tôi nhận thấy hàm lượng nước cao khi cây còn trong bình nuôi in vitro (ngày 0 và ngày 7 của quá trình luyện ex vitro ), đạt trên 92% khối lượng tươi. Tuy nhiên, khi đưa cây ra khỏi bình in vitro , hàm lượng nước giảm xuống còn 90,36% khối lượng tươi (ngày 14). Hàm lượng nước trong cây Đai châu vẫn thấp ở ngày 28 nhưng sau đó tăng lên bằng mức hàm lượng nước trong cây in vitro ở các cây 84 và 140 ngày tuổi, lần lượt bằng 92,52% và 92,34% sinh khối tươi ( Figure 1 ).
Hàm lượng chất khô trong cây lan Đai châu thời kì luyện ex vitro và trong vườn ươm biến đổi ngược lại với hàm lượng nước ( Figure 2 ). Cây in vitro có hàm lượng chất khô không cao, lần lượt đạt 7,29% (ngày 0) và 7,74% (ngày 7) khối lượng tươi. Hàm lượng chất khô tăng lên ở thời điểm ngày 14 và ngày 28, bằng 9,63% và 9,83% khối lượng tươi. Tuy nhiên, đến thời điểm ngày 84 và ngày 140, hàm lượng chất khô trong cây lần lượt đạt 7,51% và 7,65%. Sự biến đổi hàm lượng nước và hàm lượng chất khô trong cây lan Đai châu ở thời kì luyện ex vitro có thể do sự thay đổi về độ ẩm của môi trường sống. Trong những thời kì đầu, khi độ ẩm môi trường giảm xuống đột ngột, cây mất nước dẫn tới hàm lượng nước giảm, ngược lại hàm lượng chất khô tăng lên. Một nguyên nhân khác có thể làm hàm lượng nước giảm, hàm lượng chất khô tăng là hoạt động quang hợp của cây mạnh hơn ở cây ex vitro so với cây in vitro như ở khoai tây 21 . Các kết quả nghiên cứu của chúng tôi khẳng định những nghiên cứu khác về hàm lượng nước trong cây táo ở thời kì luyện ex vitro , ở loài này, cây in vitro có hàm lượng nước cao (gần 90%), hàm lượng nước này giảm xuống khoảng 60% vào ngày thứ 5 rồi tăng dần trở lại, đạt tới gần 90% vào ngày thứ 25 và 30 của quá trình luyện cây 5 . Kết quả phân tích cho thấy hàm lượng nước của cây lan Đai châu cho thấy sau thời gian mất nước mạnh ở giai đoạn đầu của quá trình luyện cây ex vitro , hàm lượng nước đã khôi phục ở mức cao sau 84 ngày thể hiện trạng thái nước bình thường của cây trong nhà lưới (lan Đai châu là cây thuộc nhóm thực vật mọng nước CAM).
Cường độ thoát hơi nước
Thoát hơi nước là quá trình sinh lý giữ vai trò quan trọng trong việc duy trì trạng thái nước, nhiệt độ lá, sự hấp thu dinh dưỡng khoáng đồng thời giữ vai trò quan trọng đối với hoạt động quang hợp và hô hấp ở thực vật 22 .
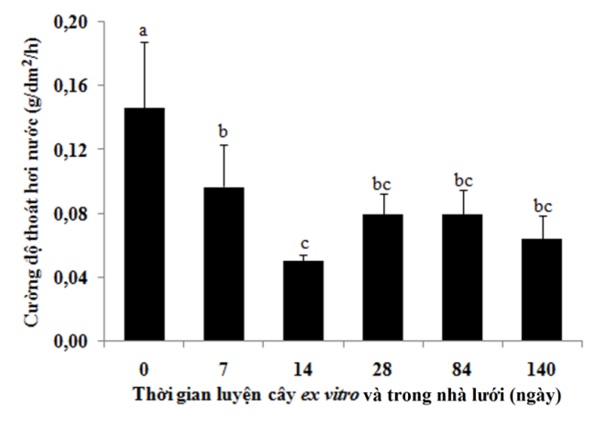
Figure 3 . Cường độ thoát hơi nước qua lá phong lan Đai châu thời kì luyện ex vitro và trong nhà lưới. Thanh sai số thể hiện giá trị độ lệch chuẩn. Các thanh sai số được đánh dấu cùng chữ cái không khác nhau có ý nghĩa thống kê (p=0,05) khi kiểm định với phép kiểm tra Duncan.
Cường độ thoát hơi nước mạnh nhất ở lá của cây phong lan Đai châu in vitro (ngày 0), đạt mức 0,146 g/dm 2 /h. Ở ngày 7, cường độ thoát hơi nước giảm xuống mức 0,097 g/dm 2 /h. Cường độ thoát hơi nước của lá giảm xuống mức thấp nhất ở thời điểm ngày 14, có thể, ở thời điểm này, cây đã mất nước nhiều nhất, hàm lượng nước trong cây còn thấp nhất nên lượng nước đi ra theo con đường thoát hơi nước giảm thấp. Ở các thời điểm ngày 28, ngày 84 và ngày 140, cường độ thoát hơi nước của lá cây lan Đai châu đều thấp hơn so với ở ngày 0 ( Figure 3 ). Một số nghiên cứu cũng đã chỉ ra cây in vitro có cường độ thoát hơi nước qua lá lớn, nguyên nhân có thể do độ mở khí khổng lớn hoặc do cây in vitro có ít sáp hoặc ít lông trên bề mặt lá trong khi mật độ khí khổng lớn. Khi cây được đưa ra ngoài tự nhiên, cường độ thoát hơi nước giảm do khí khổng đóng bớt lại hoặc có thể do tổ chức sáp hoặc lông trên bề mặt lá phát triển hơn, mật độ khí khổng giảm, sự tiêu phí nước qua quá trình thoát hơi nước đã ổn định, giúp cây thích nghi với môi trường tự nhiên 21 , 23 , 24 , 25 , 26 , 27 .
Hàm lượng proline
Figure 4 . Hàm lượng proline trong lá phong lan Đai châu thời kì luyện ex vitro và trong nhà lưới. Thanh sai số thể hiện giá trị độ lệch chuẩn. Các thanh sai số được đánh dấu cùng chữ cái không khác nhau có ý nghĩa thống kê (p=0,05) khi kiểm định với phép kiểm tra Duncan.
Proline thuộc nhóm acid amine tự do, ưa nước, có khả năng hòa tan mạnh trong nước và tạo áp suất thẩm thấu cho tế bào. Acid amine này được tích lũy trong tế bào thực vật trong điều kiện sinh lí bình thường và khi bị stress. Từ lâu, proline được chứng minh có rất nhiều vai trò trong sự phát triển cũng như tính chống chịu của thực vật, đặc biệt khi môi trường sống thay đổi 28 , 29 .
Kết quả phân tích hàm lượng proline trong mô lá của cây phong lan Đai châu ở các giai đoạn luyện cây ( Figure 4 ) cho thấy rằng hàm lượng proline trong lá đạt 73,74 µg/g ở 0 ngày nhưng tăng lên132,36 µg/g ở ngày 7. Hàm lượng của acid amine này trong lá tiếp tục tăng cao ở thời điểm ngày 14 (150,83 µg/g lá tươi). Ở các thời điểm sau, hàm lượng proline giảm xuống, bằng (ngày 28) hoặc thấp hơn (ngày 84 và ngày 140) so với ở thời điểm ban đầu. Có thể khi chuyển cây ra khỏi phòng nuôi cây, ánh sáng và sự mất nước đã kích hoạt cơ chế tự vệ bằng cách tăng sinh tổng hợp proline giống như ở nhiều loài thực vật đã biết khác khi bị đặt trong điều kiện stress 28 , 29 . Rất gần đây, trong nghiên cứu về quá trình luyện cây Pitcairnia encholirioides (họ Dứa, Bromeliaceae) in vitro của Resende et al. (2016), hàm lượng proline trong lá cây ex vitro (ngày 180) cao hơn so với cây in vitro (ngày 150 trong ống nghiệm không đóng nắp) chứa môi trường dinh dưỡng nhân tạo có bổ sung GA3. Tuy nhiên, ở loài này, trong điều kiện ống nghiệm được đóng nắp, hàm lượng proline hầu như không thay đổi giữa cây ex vitro so với cây in vitro . Cũng trong cùng nghiên cứu, nếu môi trường dinh dưỡng nhân tạo có bổ sung NAA thì hàm lượng proline trong lá cây in vitro lại cao hơn so với trong lá cây ex vitro 13 . Hàm lượng proline (amino acid được tổng hợp trong điều kiện cây bị tác động của stress) giảm xuống ở cuối giai đoạn luyện cây gợi ý rằng cây đã không còn chịu tác động của stress mất nước. Kết quả nghiên cứu này cũng có sự liên hệ với hàm lượng nước cao trong mô lá cây lan Đai châu và sự thoát hơi nước đã ổn định ở cây đã thích nghi với môi trường vào cuối giai đoạn luyện cây.
Hoạt độ guaiacol peroxidase (GPX)
Ở thực vật, các POX liên quan đến rất nhiều các quá trình sinh lý như sự phát triển vách tế bào, chữa lành vết thương, các cơ chế chống tác nhân gây bệnh và loại bỏ H 2 O 2 hình thành trong dịch bào cũng như lục lạp, chống độc tính của kim loại nặng cũng như các gốc oxi tự do hình thành từ các stress oxi hóa hay trao đổi chất tế bào 30 . Hoạt độ POX thường tăng lên khi cây chịu tác động của các stress sinh học và phi sinh học 31 .
Figure 5 . Hoạt độ GPX phong lan Đai châu thời kì luyện ex vitro . Thanh sai số thể hiện giá trị độ lệch chuẩn. Các thanh sai số được đánh dấu cùng chữ cái không khác nhau có ý nghĩa thống kê (p=0.05) khi kiểm định với phép kiểm tra Duncan.
Hoạt độ GPX của mô lá cây phong lan Đai châu đã được phân tích trong quá trình luyện cây và ở cây non trong vườn ươm ( Figure 5 ). So với cây ở ngày 0, cây lan Đai châu ở các thời điểm nghiên cứu sau của quá trình luyện cây ex vitro hay trong nhà lưới đều có hoạt độ GPX cao hơn. Hoạt độ GPX tăng mạnh ở ngày 7 (bằng 2,23 lần so với ở ngày 0) và tăng cao nhất ở ngày 14 (bằng 2,77 lần so với ở ngày 0) khi cây mất nhiều nước nhất. Sau đó hoạt độ GPX giảm xuống ở ngày 28 (bằng 1,37 lần so với ở ngày 0) và lại tăng lên ở các ngày 84 và 140 (lần lượt bằng 1,74 và 2,11 lần so với ở ngày 0).
Biến động hoạt độ GPX trong cây lan Đai châu ở thời kì đầu luyện ex vitro trong nghiên cứu này có điểm tương đồng với biến động hoạt độ GPX ở cây cỏ ngọt, theo đó, hoạt độ GPX ở cây cỏ ngọt ở các ngày 2, 7, 14 của quá trình luyện ex vitro tăng cao hơn hai lần so với cây in tro , sau đó giảm dần ở giai đoạn ngày 21 (bằng 1,2 lần so với ở cây in vitro ) và ngày 28 (bằng với ở cây in vitro ) 9 . Sự biến động hoạt độ GPX của cây lan Đai châu trong nghiên cứu này cũng có thể so sánh với sự biến động ascorbate peroxidase (APX) ở cây Đầu đài Ấn Độ 12 , hoạt độ enzyme này của cây in vitro thấp hơn so với ở cây ex vitro trong 28 ngày luyện cây. Hai enzyme này đã được chứng minh cùng có hoạt độ tăng lên khi cây gặp điều kiện bất lợi 31 . Sự tăng trở lại hoạt độ GPX ở các thời điểm ngày 84 và 140 trong nhà lưới có thể liên quan đến sự sinh trưởng của cây lan Đai châu đã thích nghi với môi trường tự nhiên, vì GPX đã được chứng minh có hoạt độ cao liên quan đến sự làm cứng thành tế bào, một bộ phận của quá trình biệt hóa ở thực vật 9 .
Nhìn chung, kết quả phân tích hàm lượng proline, hoạt độ enzyme GPX có sự liên quan đến hàm lượng nước, hàm lượng chất khô cũng như cường độ thoát hơi nước trong nghiên cứu này. Ở giai đoạn in vitro , cây có hàm lượng nước cũng như cường độ thoát hơi nước cao hơn so với cây luyện ex vitro , ngược lại, hàm lượng proline và hoạt độ GPX thấp hơn. Trong các thời điểm ngày 7, 14, 28 của quá trình luyện, khi cây được đưa ra khỏi bình in vitro , đã có hiện tượng stress mất nước diễn ra ở các mức độ khác nhau, dẫn tới kích hoạt các phản ứng hoạt hóa enzyme chống oxi hóa guaiaciol peroxidase cũng như sinh tổng hợp chất bảo vệ thẩm thấu proline, dẫn tới cường độ thoát hơi nước giảm xuống, tích lũy chất khô. Đã có nghiên cứu chỉ ra khi sử dụng proline ngoại sinh đã làm tăng sự tích lũy sinh khối và kiểm soát sự mất nước tốt hơn ở cây lan Cattleya walkeriana in vitro 32 . Ở các thời điểm 84 và 140 ngày trong nhà lưới, hàm lượng nước trong cây được khôi phục, tác động của stress mất nước giảm xuống, nên hoạt độ GPX và hàm lượng proline đều giảm xuống. Các dấu hiệu này đều góp phần chứng minh quá trình luyện cây ex vitro đã thành công, cây đã không còn bị stress khi được đưa ra khỏi môi trường in vitro .
KẾT LUẬN
Trong nghiên cứu này, một số đặc điểm sinh lí của cây phong lan Đai châu có nguồn gốc in vitro ở thời kì ex vitro và trong nhà lưới đã được phân tích. So với ở ngày 0, cây ở ngày 7 trong quá trình luyện cây vẫn có hàm lượng nước tương đương nhưng cường độ thoát hơi nước giảm thấp hơn, ngược lại, hoạt độ GPX và hàm lượng proline lại cao hơn. Hàm lượng nước và cường độ thoát hơi nước của cây giảm thấp nhất ở ngày 14, ngược lại, hàm lượng proline và hoạt độ GPX tăng cao nhất. Cây ở các thời điểm ngày 84 và ngày 140 trong nhà lưới có hàm lượng nước tương đương với thời kì in vitro nhưng cường độ thoát hơi nước cũng như hàm lượng proline thấp hơn. Ngược lại, hoạt độ GPX trong cây ở các thời điểm này đều cao hơn so với ở ngày 0.
DANH MỤC CÁC TỪ VIẾT TẮT
GPX: guaiacol peroxidase
POX: peroxidase
XUNG ĐỘT LỢI ÍCH
tác giả cam đoan không có xung đột lợi ích trong công bố bài báo này.
ĐÓNG GÓP CỦA TÁC GIẢ
Tác giả Cao Phi Bằng thiết kế, thực hiện nghiên cứu và phân tích kết quả nghiên cứu, viết bản thảo bài báo.
References
- Bui VL, Phuong NTH, Hong LTA, Thanh Van KT. High frequency shoot regeneration from Rhynchostylis gigantea (Orchidaceae) using thin cell layers. Plant Growth Regul. 1999;28(3):179-185. Google Scholar
- Rittirat S, Te-chato S, Kongruk S. Micropropagation of Chang Daeng (Rhynchostylis gigantea var. Sagarik) by embryogenic callus. Sonklanakarin J Sci Technol. 2011;33(6):659. Google Scholar
- Li Z-Y, Xu L. In vitro propagation of white-flower mutant of Rhynchostylis gigantea (Lindl.) Ridl. through immature seed-derived protocorm-like bodies. J Hortic For. 2009;1(6):093-097. Google Scholar
- Chandra S, Bandopadhyay R, Kumar V, Chandra R. Acclimatization of tissue cultured plantlets: from laboratory to land. Biotechnol Lett. 2010;32(9):1199-1205. PubMed Google Scholar
- Díaz-Pérez JC, Sutter EG, Shackel KA. Acclimatization and subsequent gas exchange, water relations, survival and growth of microcultured apple plantlets after transplanting them in soil. Physiol Plant. 1995;95(2):225-232. Google Scholar
- Misalova A, Durkovic J, Mamonova M, Priwitzer T, Lengyelova A, Hladka D, et al. Changes in leaf organisation, photosynthetic performance and wood formation during ex vitro acclimatisation of black mulberry (Morus nigra L.). Plant Biol (Stuttg). 2009;11(5):686-693. PubMed Google Scholar
- Silva AR, de Melo NF, Yano-Melo AM. Acclimatization of micropropagated plants of Etlingera elatior (Jack) R. M. Sm. inoculated with arbuscular mycorrhizal fungi. S Afr J Bot. 2017;113:164-169. Google Scholar
- Silva JAT, Hossain MM, Sharma M, Dobránszki J, Cardoso JC, Songjun Z. Acclimatization of in Vitro-derived Dendrobium. Hortic Plant J. 2017;3(3):110-124. Google Scholar
- Acosta-Motos JR, Noguera-Vera L, Barba-Espín G, Piqueras A, Hernández JA. Antioxidant Metabolism and chlorophyll fluorescence during the acclimatisation to Ex Vitro Conditions of micropropagated Stevia rebaudiana Bertoni Plants. Antioxidants. 2019;8(12):615. PubMed Google Scholar
- Sairam RK, Deshmukh PS, Saxena DC. Role of antioxidant systems in wheat genotypes tolerance to water stress. Biol. Plant. 1998;41(3):387-394. Google Scholar
- Jahan AA, Anis M. Changes in antioxidative enzymatic responses during acclimatization of in vitro raised plantlets of Cardiospermum halicacabum L. against oxidative stress. J Plant Physiol Pathol. 2014;4(2):. Google Scholar
- Faisal M, Anis M. Effect of light irradiations on photosynthetic machinery and antioxidative enzymes during ex vitro acclimatization of Tylophora indica plantlets. J Plant Interact. 2010;5(1):21-27. Google Scholar
- Resende CF, Braga VF, Pereira PF, Silva CJ, Vale VF, Bianchetti RE, et al. Proline levels, oxidative metabolism and photosynthetic pigments during in vitro growth and acclimatization of Pitcairnia encholirioides LB Sm.(Bromeliaceae). Braz. J. Biol. 2016;76(1):218-227. PubMed Google Scholar
- Huh YS, Lee JK, Nam SY. Improvement of ex vitro acclimatization of mulberry plantlets by supplement of abscisic acid to the last subculture medium. J. Plant Biotechno. 2017;44(4):431-437. Google Scholar
- Bằng CP, Huyền TTT, Phương TTT. Biến động hàm lượng sắc tố quang hợp, huỳnh quang chlorophyll và hoạt độ catalase của cây phong lan đai châu (Rhynchostylis gigantea) trong thời kì luyện ex vitro. Hội nghị khoa học Quốc gia lần thứ 2 về Nghiên cứu và giảng dạy Sinh học ở Việt Nam. Đà Nẵng, Việt Nam: NXB Đại học Quốc gia Hà Nội. 2016;:75-82. Google Scholar
- Murashige T, Skoog F. A revised medium for rapid growth and bio-assays with tobacco tissue cultures. Physiol Plant. 1962;15(3):473-497. Google Scholar
- Mã NV, Hồng LV, Phong ÔX. Phương pháp nghiên cứu Sinh lý học thực vật. Hà Nội: NXB Đại học Quốc gia Hà Nội. 2013;:97-100-166-168. Google Scholar
- Bates LS, Waldren RP, Teare ID. Rapid determination of free proline for water-stress studies. Plant Soil. 1973;39(1):205-207. Google Scholar
- Fielding JL, Hall JL. A biolchemical and cytochemical study of peroxidase activity in roots of Pisum sativum: I. a comparison of DAB-peroxidase and guaiacol-peroxidase with particular emphasis on the properties of cell wall activity. J. Exp. Bot. 1978;29(4):969-981. Google Scholar
- Dương VX, Bằng CP. Biến đổi sinh lý, hóa sinh của cây riềng bản địa Bắc Kạn (Alpinia sp.) in vitro trong thời kì ra ngôi ex vitro. Hội nghị khoa học Quốc gia lần thứ 2 về Nghiên cứu và giảng dạy Sinh học ở Việt Nam. Đà Nẵng, Việt Nam: NXB Đại học Quốc gia Hà Nội. 2016;:910-917. Google Scholar
- Pospóšilová J, Tichá I, Kadleček P, Haisel D, Plzáková Š. Acclimatization of micropropagated plants to ex vitro conditions. Biol. Plant. 1999;42(4):481-497. Google Scholar
- Yoo CY, Pence HE, Hasegawa PM, Mickelbart MV. Regulation of transpiration to improve crop water use. Crit. Rev. Plant. Sci. 2009;28(6):410-431. Google Scholar
- Kumar K, Rao IU. Morphophysiologicals problems in acclimatization of micropropagated plants in-ex vitro conditions-A review. J. Ornam.Hortic. Plants. 2012;2(4):271-283. Google Scholar
- Tichá I, Radochová B, Kadleček P. Stomatal morphology during acclimatization of tobacco plantlets to ex vitro conditions. Biol. Plant. 1999;42(3):469-474. Google Scholar
- Pospíšilová J, Wilhelmová Na, Synková H, Čatský J, Krebs D, Tichá I, et al. Acclimation of tobacco plantlets to ex vitro conditions as affected by application of abscisic acid. J Exp Bot. 1998;49(322):863-869. Google Scholar
- Chirinéa CF, Pasqual M, Araujo AGd, Pereira AR, Castro EMd. Acclimatization and leaf anatomy of micropropagated fig plantlets. Rev. Bras. Frutic. 2012;34(4):1180-1188. Google Scholar
- Darwesh, Rasmia SS. Morphology, physiology and anatomy in vitro affected acclimatization ex vitro date palm plantlets: A Review. Int. J. Chem. Environ Biol Sci. 2015;3(2):183-190. Google Scholar
- Szabados L, Savoure A. Proline: a multifunctional amino acid. Trends Plant Sci. 2010;15(2):89-97. PubMed Google Scholar
- Hayat S, Hayat Q, Alyemeni MN, Wani AS, Pichtel J, Ahmad A. Role of proline under changing environments: a review. Plant. Signal. Behav. 2012;7(11):1456-1466. PubMed Google Scholar
- Shigeto J, Tsutsumi Y. Diverse functions and reactions of class III peroxidases. New Phytol. 2016;209(4):1395-1402. PubMed Google Scholar
- Lotfi N, Vahdati K, Hassani D, Kholdebarin B, Amiri R, editors. Peroxidase, guaiacol peroxidase and ascorbate peroxidase activity accumulation in leaves and roots of walnut trees in response to drought stress. VI International Walnut Symposium. 2010;:309-316. Google Scholar
- Silva AB, Reis CO, Cazetta JO, Carlin SD, Landgraf PRC, Reis MC. Effects of exogenous proline and a natural ventilation system on the in vitro growth of orchids. Biosc. J. 2016;32(3):619-626. Google Scholar

 Open Access
Open Access