Abstract
In recent years, carbon-based solid acid catalysts have attracted a lot of attention because they meet the environmentally friendly and sustainability criteria of "green chemistry". Following that trend, in this work, the carbon-based solid acid catalyst (BM-pTSA) was successfully prepared via two-step process: bagasse pre-treatment followed by hydrothermal carbonization using as-activated carbon and p-toluenesulfonic acid. The morphology and structure of the catalyst were determined based on FT-IR, TGA, XRD and EDX spectroscopy results. The investigation of BM-pTSA activity was carried out on the synthesis of 5-hydroxymethylfurfural (5-HMF) from glucose and fructose using DMSO as solvent. The yield of 5-HMF was monitored for 16 h of reaction with temperature variationat at 80ºC, 100ºC, 120ºC for fructose and at 100ºC, 120ºC and 140ºC for glucose. Catalyst dosage investigation was also performed with 1 mg, 5 mg, 10 mg, 15 mg and 20 mg of BM-pTSA. The results show that the catalyst has a low efficiency for glucose conversion (below 13% 5-HMF) because it contains only Brønsted acid sites. The highest 5-HMF yield achieved in this study was 88,50% in the transformation of fructose with 1 mg catalyst at 120ºC, 12 h. Even so, from an economic point of view, we estimate that the most optimal reaction conditions are at 120ºC with 1 mmol fructose, 1 g DMSO and 5 mg BM-pTSA which generates a yield of 5-HMF was 67,91% after only 4 h of reaction.
GIỚI THIỆU
Đối mặt với tình trạng thiếu hụt nhiên liệu hóa thạch dẫn đến giá cả đắt đỏ và những vấn đề liên quan đến môi trường, sinh khối là một giải pháp thay thế tiềm năng được chú trọng khai thác nhờ vào tính bền vững và thân thiện đối với môi trường. 1 Một trong những mục đích của việc tận dụng nguồn năng lượng sinh khối là tổng hợp 5-hydroxymethylfurfural (5-HMF) – hợp chất hữu cơ nền tảng có nhiều ứng dụng trong ngành công nghiệp hóa chất như điều chế xăng sinh học dimethylfuran (DMF), levulinic acid, 2,5-furandicarboxylic acid (FDCA), 2,5-diformylfuran (DFF), …. 2 5-HMF thường được tổng hợp từ quá trình tách nước từ monosaccharide như glucose, fructose, … với sự có mặt của xúc tác acid trong dung môi. Trong đó, nhiều nghiên cứu đã được thực hiện với xúc tác là acid Brønsted như H 2 SO 4 , HCl, …cho thấy hiệu quả tổng hợp 5-HMF tốt từ sinh khối. 3 , 4 , 5 , 6 Tuy nhiên, các acid này lại có những nhược điểm lớn là tính ăn mòn cao, khó phân tách và gây ô nhiễm môi trường. Do đó, nhiều năm trở lại đây, những xúc tác phù hợp với xu hướng “hóa học xanh” đã được tập trung khai thác, trong đó có xúc tác acid rắn nguồn gốc carbon. Xúc tác acid rắn này được điều chế sử dụng nguồn carbon từ carbohydrate, hợp chất thơm đa vòng, nhựa polystyren, carbon hoạt hóa, than sinh học hoặc các phế phẩm nông nghiệp và tác nhân sulfon hóa là các Brønsted acid như H 2 SO 4 , p -toluenesulfonic acid…. 7 , 8 , 9 , 10 , 11 , 12
Trong nghiên cứu này, xúc tác amorphous carbon được điều chế bằng phương pháp carbon hóa thủy nhiệt từ bã mía (đã được xử lý) và sử dụng p -toluenesulfonic acid làm tác nhân sulfon hóa. Vật liệu này được sử dụng làm xúc tác cho sự chuyển hóa glucose và fructose thành 5-HMF trong dung môi DMSO. Các khảo sát về nhiệt độ, thời gian phản ứng và hàm lượng xúc tác đã được thực hiện nhằm xác định điều kiện phản ứng tốt nhất để tổng hợp 5-HMF.
VẬT LIỆU VÀ PHƯƠNG PHÁP
Vật liệu, hóa chất
Bã mía, D-glucose monohydrate ( 99%, Merck), D-fructose monohydrate ( 99%, Sigma-Aldrich), p -toluenesulfonic acid ( 99%, Sigma-Aldrich), citric acid monohydrate ( 99%, Merck), zinc chloride ( 99%, Merck), dimethyl sulfoxide ( 99,5%, Xilong).
Thiết bị
Các phản ứng được thực hiện trên máy khuấy từ điều nhiệt IKA RET BASIC (USA). Quang phổ hồng ngoại được ghi bằng máy Shimadzu IRPrestige-21 (KBr). Phân tích nhiệt trọng lượng (TGA) được ghi lại bằng máy Labsys Evo TG/DSC1600 của Setaram. Phổ tán sắc năng lượng tia X (EDX) thu được từ thiết bị EMAX Energy EX-400 EDX (Horiba).
5-HMF thu được trong quá trình khảo sát điều kiện phản ứng được định lượng trên máy sắc ký lỏng hiệu năng cao Agilent Technologies 1260 Infinity đầu dò PDA, cột sắc ký InertSustain C18 (5 µm, 4,6 x 150 mm).
Quy trình điều chế xúc tác BM-pTSA
Chất xúc tác BM- p TSA được tổng hợp qua hai bước chính ( Figure 1 ): tiền xử lý bã mía sau đó vận dụng phương pháp thủy nhiệt để điều chế vật liệu, tham khảo các quy trình đã được báo cáo bởi Xiao et al . 10 và Yusuff et al . 9 Đầu tiên, bã mía được sấy khô ở 80°C trong vòng 24 giờ và được nghiền nhỏ. Vật liệu này (20 g) được cho vào 200 mL dung dịch ZnCl 2 3 M và khuấy ở 60°C trong vòng 5 giờ. Sau khi lọc, cặn bã mía được rửa nhiều lần bằng nước cất cho đến khi pH của nước rửa trung tính. Mẫu vật liệu đã rửa sạch được làm khô trong tủ sấy ở 110°C trong vòng 24 giờ. Tiếp đến là quá trình sulfon hóa carbon bằng phương pháp thủy nhiệt được thực hiện như sau: bã mía đã than hóa (10 g), citric acid monohydrate (4 g, 20 mmol), p -toluenesulfonic acid (2 g, 10 mmol) và 80 mL nước cất lần lượt được cho vào ống Teflon, rồi nung ở 180°C trong 6 giờ. Xúc tác acid rắn (BM- p TSA) thu được sau khi được rửa nhiều lần với nước cất và được sấy khô trong lò ở 80ºC trong 8 giờ. Bảo quản xúc tác trong bình hút ẩm để sử dụng cho các phản ứng tiếp theo.
Quy trình tổng hợp 5- HMF
5-HMF được tổng hợp với sự tham khảo quy trình được báo cáo bởi Wang và cộng sự. 13 Cho hỗn hợp glucose (1 mmol), dung môi DMSO (1 g), xúc tác BM- p TSA (10 mg) vào bình cầu 25 mL. Hỗn hợp phản ứng được đun nóng bằng bếp khuấy từ ở nhiệt độ 100ºC, 120ºC và 140ºC trong 16 giờ. Hàm lượng và quy trình tương tự được áp dụng cho fructose với nhiệt độ phản ứng là 80ºC, 100ºC và 120ºC trong 16 giờ. Khảo sát hàm lượng xúc tác cũng đã được thực hiện với 1 mg, 5 mg, 10 mg, 15 mg và 20 mg BM- p TSA ở 120ºC. Tiến trình của phản ứng được theo dõi bằng sắc ký lỏng hiệu năng cao (HPLC).
Khảo sát hoạt tính xúc tác BM-pTSA trong phản ứng điều chế 5-HMF từ glucose và fructose
Điều kiện phản ứng: Glucose (1 mmol), DMSO (1 g), xúc tác BM- p TSA (10 mg) khuấy từ ở 100ºC, 120ºC và 140ºC trong 16 giờ. Hàm lượng và quy trình tương tự được áp dụng cho fructose với nhiệt độ phản ứng là 80ºC, 100ºC và 120ºC trong 16 giờ. Khảo sát hàm lượng xúc tác cũng đã được thực hiện với 1 mg, 5 mg, 10 mg, 15 mg và 20 mg BM- p TSA ở 120ºC.
KẾT QUẢ VÀ THẢO LUẬN
Đặc điểm cấu trúc của BM-pTSA
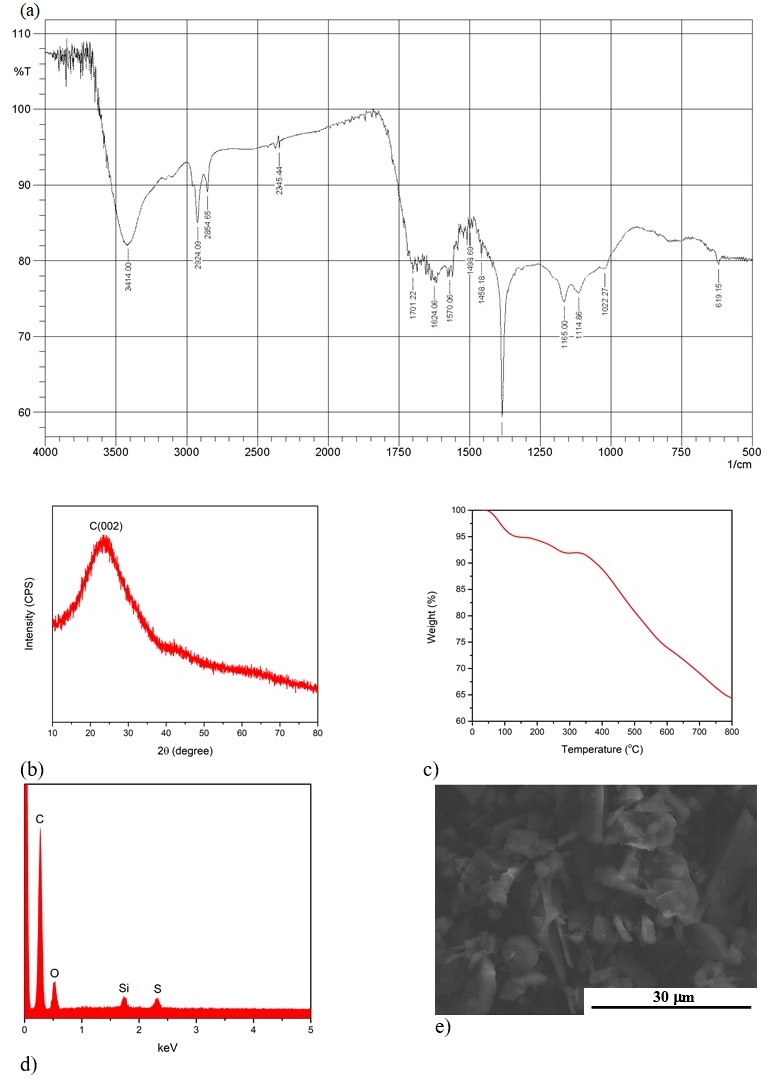
Phổ FT-IR của mẫu xúc tác ( Figure 2 a) cho thấy vùng hấp thụ ~3414 cm -1 đặc trưng cho nhóm -OH của nhóm -COOH carboxylic và các nhóm phenolic OH. 9, 11 Tại 1624 cm -1 có mũi C=C trong các vòng thơm. Những tín hiệu ở 1165 cm -1 và 1022 cm -1 biểu thị các dao động của SO 3 - và O=S=O. 9, 11 Những kết quả trên chứng tỏ sự có mặt của các nhóm phenolic hydroxyl, carboxyl, sulfonic acid và carboxylic trên bề mặt chất xúc tác BM- p TSA.
Quan sát Figure 2 -b, phổ XRD của xúc tác BM- p TSA, có thể nhận thấy một mũi rộng C(002) có 2θ = 10 - 30°. Điều này chứng tỏ cấu trúc vật liệu là các lớp nguyên tử carbon vòng thơm định hướng một cách ngẫu nhiên. 12
Kết quả TGA của vật liệu ( Figure 2 c) cho thấy có sự sụt giảm dần khối lượng xúc tác ở khoảng trước 100ºC, điều này xảy ra là do sự bay hơi nước còn trong vật liệu. Ở nhiệt độ cao hơn 350ºC, tốc độ giảm khối lượng nhanh hơn vì sự giải hấp và phân hủy của các nhóm chức hữu cơ. Như vậy, có thể kết luận rằng xúc tác BM- p TSA có độ bền nhiệt lên đến 300ºC.
Phổ EDX ( Figure 2 d) chứng tỏ sự tồn tại của các nguyên tố C, O, Si, S trong mẫu vật liệu BM- p TSA. Hình thái bề mặt giống bọt biển, cấu trúc không đồng đều và thô ráp của BM- p TSA cũng được xác định thông qua ảnh SEM ( Figure 2 e), tương tự như báo cáo của Ngaosuwan và cộng sự. 11
Figure 2 . Đặc điểm cấu trúc, hình thái của BM-pTSA: (a) FT-IR; (b) Phổ XRD; (c) TGA; (d) Phổ EDX; (e) Ảnh SEM.
Phổ 1H NMR và 13C NMR của 5-HMF
1 H NMR (500 MHz, CDCl 3 ) δ 9,58 (s, 1H), 7,21 (d, J = 3,5 Hz, 1H), 6,51 (d, J = 3,4 Hz, 1H), 4,71 (s, 2H). 13 C NMR (125 MHz, CDCl 3 ) δ 177,6; 160,6; 152,4; 122,6; 109,9; 57,6.
Các điều kiện ảnh hưởng đến hoạt tính xúc tác BM-pTSA trong phản ứng điều chế 5-HMF từ glucose và fructose
Ảnh hưởng của nhiệt độ và thời gian phản ứng
Các khảo sát đều được tiến hành với cả glucose và fructose cho thấy sự khác biệt rõ rệt trong hiệu quả tổng hợp 5-HMF. Figure 3 cho thấy quy trình áp dụng cho sự chuyển hóa glucose thành 5-HMF mang lại hiệu quả chưa cao. Khi phản ứng được gia nhiệt ở 100ºC, chỉ 1,88% 5-HMF được hình thành sau 16 giờ. Cùng khoảng thời gian đó, hiệu suất sản phẩm chính cũng chỉ đạt khoảng 12-13% ở nhiệt độ 120ºC và 140ºC. Điều này là do con đường điều chế 5-HMF từ glucose phải đi qua bước đồng phân hóa glucose thành fructose, yêu cầu cần có sự hỗ trợ của xúc tác Lewis acid. Tuy nhiên, trong hệ phản ứng không có mặt loại acid này, dẫn tới sự khó khăn trong tổng hợp 5-HMF mặc dù nhiệt độ phản ứng được nâng cao. Ngược lại, fructose cho thấy hiệu quả tổng hợp 5-HMF tốt hơn nhiều ( Figure 4 ).
Figure 3 . Hiệu suất 5-HMF được tổng hợp từ glucose theo thời gian ở 100°C, 120°C và 140°C. Điều kiện phản ứng: glucose (1 mmol), DMSO (1 g), BM- p TSA (10 mg).
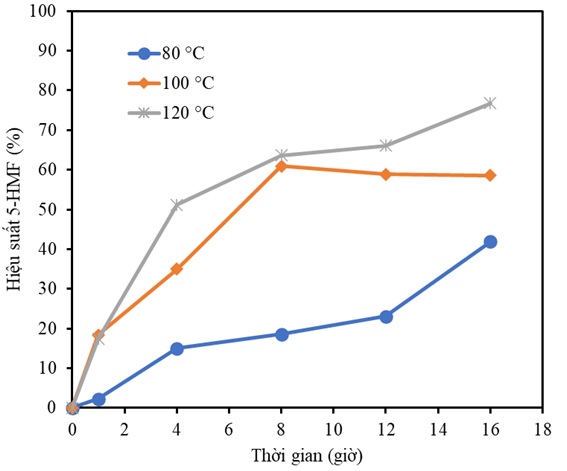
Figure 4 . Hiệu suất 5-HMF được tổng hợp từ fructose theo thời gian ở 80°C, 100°C và 120°C. Điều kiện phản ứng: fructose (1 mmol), DMSO (1 g), BM- p TSA (10 mg).
Hiệu suất 5-HMF ở 80ºC đạt cao nhất là 41,92% sau 16 giờ. Con số này được tăng lên đến 60,91% khi phản ứng được gia nhiệt ở 100ºC sau 8 giờ và duy trì ở khoảng 59% trong 8 giờ tiếp theo. Khảo sát ở 120ºC ghi nhận hàm lượng 5-HMF đạt 51,21 % sau 4 giờ và đạt cao nhất 76,75% sau 16 giờ phản ứng. Xem xét về mặt kinh tế, trong trường hợp này, có thể thấy thời gian phản ứng 4 giờ là có triển vọng hơn bởi vì trong khi thời gian phản ứng kéo dài gấp 4 lần (tiêu tốn gấp 4 lần năng lượng), hàm lượng 5-HMF chỉ tăng khoảng 1,5 lần. Thêm vào đó, việc kéo dài thời gian phản ứng sẽ tạo điều kiện cho sự hình các sản phẩm phụ, gây khó khăn cho quá trình phân tách sản phẩm. Từ các kết quả ở trên, điều kiện nhiệt độ 120ºC sẽ được áp dụng cố định cho các khảo sát tiếp theo trong nghiên cứu này.
Ảnh hưởng của hàm lượng xúc tác
Đối với quy trình áp dụng cho glucose, qua từng khoảng thời gian, hầu như không có sự khác biệt quá lớn của hiệu suất 5-HMF thu được giữa các phản ứng sử dụng lượng BM- p TSA khác nhau ( Figure 5 ). Không quá 13% 5-HMF được tạo thành từ các khảo sát này. Những số liệu đáng chú ý đến từ quy trình chuyển hóa fructose. Quan sát Figure 6 , sau 1 giờ phản ứng, với hàm lượng 20 mg xúc tác, 57,58% 5-HMF đã được ghi nhận, thấp hơn là các phản ứng có lượng BM- p TSA là 15 mg, 5 mg, 1 mg và 10 mg với hiệu suất 5-HMF lần lượt là 52,09%, 40,98%, 25,76% và 17,36%.
Figure 5 . Hiệu suất 5-HMF được tổng hợp từ glucose theo thời gian với sự xúc tác bới 1 mg, 5 mg, 10 mg, 15 mg và 20 mg BM- p TSA. Điều kiện phản ứng: glucose (1 mmol), DMSO (1 g), 120°C.
Figure 6 . Hiệu suất 5-HMF được tổng hợp từ fructose theo thời gian với sự xúc tác bới 1 mg, 5 mg, 10 mg, 15 mg và 20 mg BM- p TSA. Điều kiện phản ứng: fructose (1 mmol), DMSO (1 g), 120°C.
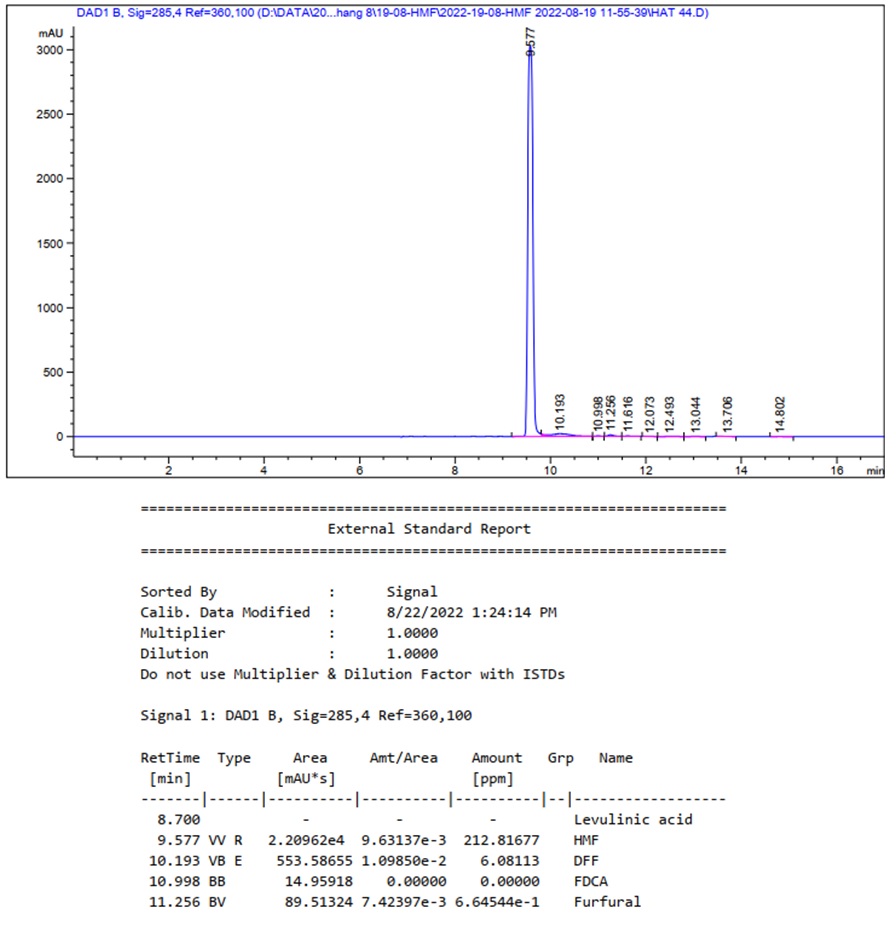
Sau đó, hiệu suất 5-HMF của các phản ứng đều tăng, và hầu hết đạt cao nhất sau 12 giờ phản ứng. Sự giảm hàm lượng sản phẩm chính sau 16 giờ là do sự phân hủy dần 5-HMF tạo các sản phẩm phụ. Việc tăng quá nhiều lượng xúc tác làm cho sự phân hủy này xảy ra sớm hơn và nghiêm trọng hơn, bằng chứng là khi dùng 20 mg BM- p TSA, hiệu suất sản phẩm cao nhất là 79,82% sau 8 giờ và giảm còn 58,84% sau 12 giờ phản ứng. Điểm hiệu suất cao nhất được ghi nhận ở nghiên cứu này là 88,50% 5-HMF với 1 mg xúc tác, sau 12 giờ phản ứng. Tuy nhiên, thời gian phản ứng kéo dài là không có lợi về nhiều mặt, do đó, sau khi xem xét thêm các yếu tố như hàm lượng xúc tác, hiệu suất sản phẩm, nhận thấy phản ứng sử dụng 5 mg BM- p TSA là tối ưu nhất (67,91% 5-HMF, 4 giờ). Figure 7 là kết quả định lượng 5-HMF được tổng hợp từ phản ứng trên bằng phương pháp sắc ký lỏng hiệu năng cao.
Figure 7 . Kết quả HPLC của phản ứng điều chế 5-HMF. Điều kiện phản ứng: fructose (1 mmol), BM- p TSA (5 mg), DMSO (1 g), 4 giờ, 120°C.
KẾT LUẬN
Chúng tôi đã điều chế thành công chất xúc tác amorphous carbon gắn các nhóm -SO 3 H, -OH và -COOH bằng cách than hóa nguyên liệu bã mía, sau đó là sulfon hóa với p -toluenesulfonic acid để tạo ra xúc tác rắn có tính acid Brønsted. Hoạt tính của chất xúc tác được thể hiện rõ rệt qua phản ứng chuyển hóa glucose và fructose thành 5-HMF trong dung môi DMSO. Đặc biệt, hiệu suất 5-HMF tối ưu là 67,91% tại nhiệt độ phản ứng 120ºC trong 4 giờ với hàm lượng fructose 1 mmol, DMSO 1 g và xúc tác BM- p TSA 5 mg. Trong khi đó, quy trình chuyển hóa glucose cho hiệu quả sản xuất 5-HMF thấp hơn vì thiếu sự hiện diện của acid Lewis, thành phần thúc đẩy cho quá trình đồng phân hóa glucose thành fructose diễn ra thuận lợi. Các kết quả khảo sát nhiệt độ phản ứng và hàm lượng xúc tác cho thấy, khi nhiệt độ phản ứng và hàm lượng xúc tác cao sẽ làm giảm đi hiệu suất 5-HMF do sự hình thành của humin và các tạp chất khác.
LỜI CẢM ƠN
Nghiên cứu này được tài trợ bởi Đại học Quốc gia TP. Hồ Chí Minh (ĐHQG-HCM) trong khuôn khổ Đề tài mã số 562-2022-18-03.
DANH MỤC CÁC TỪ VIẾT TẮT
5-HMF: 5-Hydroxymethylfurfural
DMSO: Dimethyl sulfoxide
BM- p TSA: Xúc tác p -toluenesulfonic acid gắn trên nền carbon từ bã mía
FT-IR: Quang phổ hồng ngoại
TGA: Phân tích nhiệt trọng lượng
XRD: Quang phổ nhiễu xạ tia X
EDX: Phổ tán sắc năng lượng tia X
SEM: Kính hiển vi điện tử quét
HPLC: Sắc ký lỏng hiệu năng cao
XUNG ĐỘT LỢI ÍCH
Các tác giả tuyên bố rằng họ không có xung đột lợi ích.
ĐÓNG GÓP CỦA TÁC GIẢ
Nguyễn Thị Thiên Hằng đóng góp thực hiện thực nghiệm, thu thập số liệu, viết bản thảo. Nguyễn Hào Trình, Phan Bích Hà và Phan Ngọc Quỳnh Anh đóng góp thực hiện thực nghiệm và thu thập số liệu. Trần Hoàng Phương đóng góp trong việc hỗ trợ khảo sát, góp ý và chỉnh sửa bản thảo.
References
- Mosier N, Wyman C, Dale B, Elander R, Lee YY, Holtzapple M, et al. Features of promising technologies for pretreatment of lignocellulosic biomass. Bioresour Technol. 2005;96(6):673-86. . ;:. PubMed Google Scholar
- Rosatella AA, Simeonov SP, Frade RFM, Afonso CAM. 5-hydroxymethylfurfural (HMF) as a building block platform: biological properties, synthesis and synthetic applications. Green Chem. 2011;13(4):754-93. . ;:. Google Scholar
- Román-Leshkov Y, Chheda JN, Dumesic JA. Phase modifiers promote efficient production of hydroxymethylfurfural from fructose. Science. 2006;312(5782):1933-7. . ;:. PubMed Google Scholar
- Thananatthanachon T, Rauchfuss TB. Efficient production of the liquid fuel 2, 5‐dimethylfuran from fructose using formic acid as a reagent. Angew. Chem., 2010. 122(37): p. 6766-6768. . ;:. Google Scholar
- Hansen TS, Mielby J, Riisager A. Synergy of boric acid and added salts in the catalytic dehydration of hexoses to 5-hydroxymethylfurfural in water. Green Chem. 2011;13(1):109-14. . ;:. Google Scholar
- Chheda JN, Román-Leshkov Y, Dumesic JA. Production of 5-hydroxymethylfurfural and furfural by dehydration of biomass-derived mono- and polysaccharides. Green Chem. 2007;9(4):342-50. . ;:. Google Scholar
- Xing R, Liu Y, Wang Y, Chen L, Wu H, Jiang Y, et al. Active solid acid catalysts prepared by sulfonation of carbonization-controlled mesoporous carbon materials. Micropor Mesopor Mater. 2007;105(1-2):41-8. . ;:. Google Scholar
- Suganuma S, Nakajima K, Kitano M, Yamaguchi D, Kato H, Hayashi S, et al. Hydrolysis of cellulose by amorphous carbon bearing SO3H, COOH, and OH groups. J Am Chem Soc. 2008;130(38):12787-93. . ;:. PubMed Google Scholar
- Yusuff AS, Thompson-Yusuff KA, Porwal J. Sulfonated biochar catalyst derived from eucalyptus tree shed bark: synthesis, characterization and its evaluation in oleic acid esterification. RSC Adv. 2022;12(17):10237-48. . ;:. PubMed Google Scholar
- Xiao H, Guo Y, Liang X, Qi C. One-step synthesis of novel biacidic carbon via hydrothermal carbonization. J Solid State Chem. 2010;183(7):1721-5. . ;:. Google Scholar
- Ngaosuwan K, Goodwin JG Jr, Prasertdham P. A green sulfonated carbon-based catalyst derived from coffee residue for esterification. Renew Energy. 2016;86:262-9. . ;:. Google Scholar
- Zhao C, Lv P, Yang L, Xing S, Luo W, Wang Z. Biodiesel synthesis over biochar-based catalyst from biomass waste pomelo peel. Energy Convers Manag. 2018;160:477-85. . ;:. Google Scholar
- Wang J, Xu W, Ren J, Liu X, Lu G, Wang Y. Efficient catalytic conversion of fructose into hydroxymethylfurfural by a novel carbon-based solid acid. Green Chem. 2011;13(10):2678-81. . ;:. Google Scholar

 Open Access
Open Access