Abstract
The disorder of endometrial tissue regeneration is the main cause of uterine adhesions, amenorrhea, and infertility in women. Monthly changes in the endometrial cycle and injured uterine regeneration confirm the role of stem cells, hormonal regulation as well as endometrial tissue structure. In previous studies, the use of a single or combined stem cell therapy, hormone therapy, and scaffold transplantation had been increasingly emphasized. This paper presented the evaluatation of the role of the stem cell and matrix combination in the presence of estrogen hormone in endometrial regeneration on the human injured uterine tissue model. Human uterine tissue fragments were collected and mechanically damaged for in vitro modeling. The fibrin scaffolds were fabricated and combined with, respectively, human adipose tissue stem cells (hADSCs) and human bone marrow stem cells (hBMSCs) to be treated in an established injured model in conditions with or without estrogen. Histological assessments were performed to compare and confirm the regenerative effect of the treatments after 14 days of investigation. The results showed that there was no difference in the histological structure between the control treatment (no treatment) and the single treatment with stem cells. However, when stem cells were combined with fibrin matrix in the presence of estrogen, the uterine glands were formed where the layered structure of the endometrium was clearly demonstrated. In conclusion, the endometrial regenerating effect was well established by the combined treatment of these stem cells with fibrin scaffolds in the presence of estrogen. The combination of cells and scaffolds in tissue engineering therapy gradually showed the potential applications for in vitro studies, especially in the field of infertility treatment.
GIỚI THIỆU
Tổ chức Y tế Thế giới định nghĩa vô sinh là bệnh lý dẫn đến không thể thụ thai sau ít nhất một năm giao hợp mà không sử dụng bất kỳ một biện pháp tránh thai nào. Những phát triển gần đây trong công nghệ hỗ trợ sinh sản đã thúc đẩy tạo ra nhiều sự lựa chọn trong điều trị và mang lại thành công cho nhiều bệnh nhân hiếm muộn. Tuy nhiên, phương pháp điều trị đặc hiệu cho vô sinh do yếu tố tử cung vẫn chưa được thiết lập. Theo một báo cáo năm 2015 của Trung tâm Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh Hoa Kỳ, có khoảng 6% phụ nữ đang điều trị vô sinh có tử cung bị rối loạn chức năng 1 , 2 . Bên cạnh đó, 36–53 triệu ca mang thai trên toàn thế giới bị chấm dứt thai kỳ hàng năm, trong đó khoảng 90% xảy ra trong tam cá nguyệt đầu tiên. Tỉ lệ sẩy thai sớm là khoảng 6,3% ở những bệnh nhân có tiền sử tổn thương nội mạc tử cung 3 .
Các liệu pháp tái tạo cơ quan được thiết lập vào những năm 1970, dựa trên việc nuôi cấy các tế bào đã biệt hóa, chẳng hạn như tế bào biểu bì và tế bào sụn 4 . Langer và Vacanti 5 đã chỉ ra rằng việc sử dụng giá thể cho phép các tế bào phát triển tại các vị trí cấy ghép hiệu quả hơn so với việc tiêm trực tiếp dịch chứa tế bào. Mặc dù, vào năm 2014, việc cấy ghép tử cung đã mang lại kết quả sinh con thành công ở một bệnh nhân bị lão hóa tử cung 6 . Tuy nhiên, việc cấy ghép tử cung gặp nhiều trở ngại, thí dụ như tình trạng thiếu người hiến tặng, có thể bị đào thải và việc sử dụng thuốc ức chế miễn dịch trong thời gian dài 7 .
Tiến bộ mới nhất trong kỹ nghệ mô và y học tái tạo là sử dụng vật liệu sinh học thúc đẩy sự tái tạo và sửa chữa mô thông qua việc phóng thích các yếu tố hoạt tính sinh học vào các vị trí bị tổn thương của mô 3 . Sự kết hợp giữa giá thể có nguồn gốc sinh học với liệu pháp tế bào gốc đã cho thấy tiềm năng cho việc sửa chữa chức năng của nội mạc tử cung. Theo các báo cáo, bệnh nhân bị tổn thương nội mạc tử cung đã được cấy ghép tế bào gốc trung mô tủy xương (BM-MSCs), tế bào gốc trung mô nội mạc tử cung (eMSCs) và tế bào gốc từ máu kinh nguyệt (MenSCs) vào khoang tử cung thông qua các giá thể sinh học, có thể kích thích sự phát triển của nội mạc tử cung 8 , 9 . Mặc dù bước đầu liệu pháp kết hợp tế bào gốc và giá thể có nguồn gốc sinh học đã khẳng định hiệu quả tái tạo trong cấy ghép. Tuy vậy, đến nay, vẫn chưa có phác đồ điều trị cụ thể cho việc điều trị tổn thương nội mạc tử cung.
Nghiên cứu này được thực hiện nhằm thiết lập liệu pháp kỹ nghệ mô trong điều trị tổn thương nội mạc tử cung in vitro bằng cách kết hợp giá thể fibrin và tế bào gốc trung mô (có nguồn gốc mô mỡ và tủy xương). Bên cạnh đó, nghiên cứu cũng giúp xác định vai trò hormone estrogen trong sự kết hợp này.
VẬT LIỆU VÀ PHƯƠNG PHÁP
Đối tượng nghiên cứu
Mẫu máu ngoại vi được thu nhận từ người tình nguyện khỏe mạnh đã được xét nghiệm âm tính với HIV, HBV, HCV và giang mai. Mô tử cung được thu nhận từ các bệnh nhân hiến tặng có chỉ định cắt tử cung toàn phần, không mắc các bệnh lý ung thư nội mạc tử cung, lạc nội mạc tử cung, u xơ tử cung.
Việc thu nhận máu ngoại vi và mô tử cung ở người tình nguyện được thực hiện sau khi thông qua Hội đồng Y đức (Số 2395/GCN-BVHV), Bệnh viện Hùng Vương tại Thành phố Hồ Chí Minh)
Phương pháp tạo mô hình mô tử cung mất lớp nội mạc tử cung
Mô tử cung người sau khi được thu nhận được bảo quản trong dung dịch muối đệm phosphate (PBS) 1X kháng sinh (Sigma, USA) ở 4 o C và vận chuyển về phòng thí nghiệm trong 2 giờ. Phương pháp tạo mô hình này nhằm mô phỏng lại thao tác nạo phá thai bằng cách sử dụng cây nạo để nạo sạch lớp nội mạc và dùng gạc y tế vô trùng chà xát nhiều lần để loại bỏ hoàn toàn lớp nội mạc tử cung. Hiệu quả loại bỏ lớp nội mạc được đánh giá bằng phương pháp nhuộm H&E. Sau đó, các mảnh mô tử cung bị tổn thương được duy trì trong môi trường DMEM/F12 (Sigma, USA) có bổ sung 10% FBS (Sigma, USA), 1% kháng sinh (Sigma, USA) và đánh giá mức độ tổn thương sau 7 và 14 ngày.
Phương pháp chuẩn bị tế bào gốc cho điều trị
Các dòng tế bào gốc trung mô từ mô mỡ người (hADSC) và tế bào gốc trung mô từ tủy xương người (hBMSC) được cung cấp bởi Phòng thí nghiệm Kỹ nghệ mô và Vật liệu Y sinh, Trường Đại học Khoa học Tự nhiên, Đại học quốc gia thành phố Hồ Chí Minh. Các dòng tế bào hADSC và hBMSC được nuôi cấy đến thế hệ thứ 4 (P4) thì được tách khỏi bề mặt chai nuôi bằng Trypsin/(Sigma, USA).
Phương pháp tạo giá thể fibrin và chuẩn bị phức hợp tế bào–giá thể fibrin
Giá thể fibrin được chế tạo theo quy trình đã được công bố của chính nhóm nghiên cứu 10 . Huyết tương từ máu ngoại vi người được cho vào dụng cụ tạo khuôn, bổ sung dung dịch CaCl 2 0,8 M (Sigma, USA) với tỉ lệ 4:1, để dung dịch ở nhiệt độ phòng cho đến khi hình thành khối gel.
Phức hợp tế bào–khung fibrin được chuẩn bị bằng cách huyền phù 5x10 4 tế bào trong 0,3 mL huyết tương. Sau đó dung dịch huyết tương được bổ sung thêm 0,075 mL CaCl 2 0,8 M để tạo khung fibrin chứa tế bào.
Phương pháp trị liệu trên mô hình mô tử cung mất lớp nội mạc
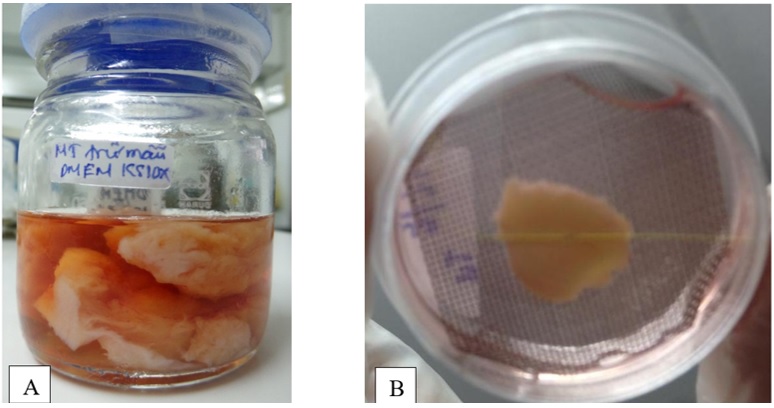
Các mảnh mô tử cung bị mất lớp nội mạc được cắt nhỏ đạt kích thước 5x5 mm ( Figure 1 ). Mảnh mô được đặt vào đĩa Ø35, được cố định bằng lưới thép không gỉ. Các mảnh mô được điều trị tái tạo theo các nhóm nghiệm thức sau: (1) bơm trực tiếp dịch huyền phù hADSC; (2) bơm trực tiếp dịch huyền phù hBMSC; (3), (4) bơm phức hợp hADSC (5x10 4 tế bào)–fibrin và nuôi cấy trong môi trường có bổ sung tương ứng estrogen (Sigma, USA) nồng độ 4x10 4 mg/mL, 8x10 4 mg/mL; (5), (6) bơm phức hợp hBMSCs (5x10 4 tế bào)–fibrin và nuôi cấy trong môi trường có bổ sung tương ứng estrogen nồng độ 4x10 4 mg/mL, 8x10 4 mg/mL. Các mảnh mô sau điều trị được nuôi cấy 14 ngày ở điều kiện 37 o C, 5% CO 2 .
Figure 1 . Hình ảnh thu nhận và nuôi cấy mô tử cung A. Mô tử cung thu nhận từ bệnh nhân; B.Mô tử cung trong môi trường nuôi cấy
Phương pháp đánh giá hiệu quả điều trị
Thuốc nhuộm hematoxylin và eosin được sử dụng để đánh giá sự thay đổi cấu trúc mô trong quá trình nuôi cấy. Mẫu mô được cố định bằng dung dịch formalin 10% và gửi đến Bộ môn Mô phôi và Giải phẫu bệnh trường Đại học Y dược thành phố Hồ Chí Minh để nhuộm H&E.
KẾT QUẢ
Kết quả tạo mô hình mô tử cung bị mất lớp nội mạc
Ở tử cung, mặt nội mạc có thể được phân biệt với mặt thanh mạc bằng mắt thường. Mặt nội mạc dày, gồ ghề, nhớt và mềm, có thể có màu đỏ máu hoặc hồng phớt, trong khi mặt thanh mạc có màu đỏ sẫm, nhẵn và chắc chắn hơn. Đây là đặc điểm để chọn đúng mặt nội mạc trong việc loại bỏ lớp nội mạc tử cung.
Figure 2 . Hình ảnh mô tử cung người trước và sau khi xử lý loại bỏ lớp nội mạc (40X) (mũi tên màu đỏ chỉ các ống tuyến, mũi tên đen chỉ độ dày nội mạc)
Trước khi xử lý; B. Sau khi xử lý 7 ngày; C. Sau khi xử lý 14 ngày
Kết quả từ Figure 2 cho thấy, trước khi nạo, mô tử cung người có cấu trúc bình thường gồm lớp cơ và lớp nội mạc, trong lớp nội mạc có các tế bào biểu mô nội mạc tử cung, hệ thống ống tuyến với lớp tế bào biểu mô tuyến trụ đơn đặc trưng và mạch máu. Với phương pháp cơ học, lớp nội mạc đã được loại bỏ hoàn toàn đến tầng đáy và cấu trúc này duy trì sau 7 và 14 ngày nuôi cấy. Tại thời điểm ngày 7 và 14 sau tác động tổn thương, hoàn toàn không quan sát được hệ thống tuyến tử cung hay mạch máu trong cấu trúc mô nuôi cấy. Bên cạnh đó, bề mặt mảnh mô không quan sát được biểu mô nội mạc. Do vậy đến 14 ngày sau khi tạo mô hình, mô tử cung vẫn không có khả năng tái tạo lại lớp nội mạc đã bị tổn thương.
Kết quả tái tạo mô nội mạc tử cung sau điều trị
Sau khi được điều trị với nhiều liệu pháp khác nhau, mô tử cung bị tổn thương cho thấy khả năng tái tạo khác nhau thông qua cấu trúc mô học. Cụ thể, trong các nghiệm thức chỉ sử dụng hADSC và hBMSC được bơm trực tiếp lên bề mặt, các tế bào này không hình thành được cấu trúc mới mô phỏng lớp nội mạc đã mất sau 7 và 14 ngày ( Figure 3 A, Figure 3 B, Figure 4 A, Figure 4 B). Hình ảnh mô học cho thấy cấu trúc mô cơ được thể hiện khá rõ nét, không ghi nhận được hệ thống tuyến tử cung, mạch máu hay các tế bào biểu mô nội mạc ở các nhóm nghiệm thức này.
Figure 3 . Ảnh hưởng của hADSC và gel fibrin lên sự hình thành cấu trúc mô phỏng nội mạc tử cung (40X) (mũi tên đỏ chỉ các ống tuyến mới được hình thành). A, B: cấu trúc của mô hình mô tử cung người bị mất lớp nội mạc được bơm trực tiếp hADSC sau 7, 14 ngày; C, D: cấu trúc của mô hình mô tử cung người bị mất lớp nội mạc được bơm phức hợp hADSC và gel fibrin và nuôi cấy trong môi trường có bổ sung estrogen nồng độ 4x10 -4 mg/ml sau 7, 14 ngày; E, F: cấu trúc của mô hình mô tử cung người bị mất lớp nội mạc được bơm phức hợp hADSC và gel fibrin và nuôi cấy trong môi trường có bổ sung estrogen nồng độ 8x10 -4 mg/ml sau 7, 14 ngày.
Figure 4 . Ảnh hưởng của hBMSC và gel fibrin lên sự hình thành cấu trúc mô phỏng nội mạc tử cung (40X) (mũi tên đỏ chỉ các ống tuyến mới được hình thành). A, B: cấu trúc của mô hình mô tử cung người bị mất lớp nội mạc được bơm trực tiếp hBMSC sau 7, 14 ngày; C, D: cấu trúc của mô hình mô tử cung người bị mất lớp nội mạc được bơm phức hợp hBMSC và gel fibrin và nuôi cấy trong môi trường có bổ sung estrogen nồng độ 4x10 -4 mg/ml sau 7, 14 ngày; E, F: cấu trúc của mô hình mô tử cung người bị mất lớp nội mạc được bơm phức hợp hBMSC và gel fibrin và nuôi cấy trong môi trường có bổ sung estrogen nồng độ 8x10 -4 mg/ml sau 7, 14 ngày hBMSC và gel fibrin lên sau 7, 14 ngày.
Tuy nhiên, ở các nhóm nghiệm thức kết hợp tế bào hADSC hoặc hBMSC với giá thể fibrin trong sự hiện diện của estrogen có sự khác biệt trong hình ảnh mô học. Cấu trúc mô bên trên mô cơ xuất hiện và duy trì sau 14 ngày thực hiện liệu pháp điều trị. Bên cạnh đó, hệ thống giống tuyến tử cung xuất hiện ở cả 4 nhóm nghiệm thức 3, 4, 5, 6 này, và rõ ràng nhất ở nhóm nghiệm thức kết hợp tế bào hADSC hoặc hBMSC với giá thể fibrin với estrogen nồng độ 8.10 4 mg/mL sau 14 ngày nuôi cấy ( Figure 3 C-F, Figure 4 C-F). Tuy vậy, các cấu trúc giống tuyến này chứa các tế bào biểu mô chưa có hình thái trụ đơn rõ ràng như ở mô chưa gây tổn thương. Bên cạnh đó, tất cả các nhóm nghiệm thức đều không thể hiện được sự tái tạo biểu mô nội mạc tử cung sau điều trị.
THẢO LUẬN
Kết quả cho thấy việc kết hợp tế bào gốc (hADSCs hay hBMSCs) với giá thể sinh học cùng sự hiện diện của hormone sinh dục estrogen ở nồng độ 8x10 -4 mg/mL đã thúc đẩy sự tái tạo nội mạc tử cung, cấu trúc nội mạc dần được hình thành với sự hiện diện của cấu trúc giống tuyến tử cung. Đến nay, vẫn chưa rõ loại tế bào nào tốt nhất có thể được cấy ghép trong liệu pháp tái tạo tử cung. Các dòng tế bào gốc đa năng như tế bào gốc mô mỡ người (hADSC), tế bào gốc tủy xương người (hBMSC), tế bào gốc trung mô từ dây rốn (hUCMSC) và các tế bào gốc nội mạc tử cung (hESC) đều đã được sử dụng; tuy nhiên, không có nghiên cứu nào cho thấy những tế bào này biệt hóa trực tiếp thành tế bào nội mạc tử cung và tế bào cơ tử cung. Do đó, cần phải kiểm tra xem các tế bào này ảnh hưởng và góp phần như thế nào trong việc sửa chữa các tổn thương mô tử cung 2 . Bên cạnh đó, giá thể sinh học có thể hỗ trợ sự gắn kết và tăng sinh của các tế bào nội mạc tử cung. Giá thể được xác định là cần thiết để hỗ trợ các tế bào phục hồi về mặt cấu trúc và chức năng trước hoặc sau khi ghép. Các nghiên cứu hiện nay đã chứng minh rằng, giá thể sinh học kết hợp với tế bào gốc hoặc các yếu tố trị liệu (chẳng hạn như liệu pháp hormone) tác động vào tử cung đã đạt được những hiệu quả nhất định, trong điều trị bệnh nhân bị tổn thương nội mạc tử cung hoặc trên động vật mô hình 2 , 3 . Fibrin là một loại giá thể sinh học có cấu trúc xốp, tạo thành các lỗ do các sợi protein đan vào nhau mà tạo thành. Các lỗ xốp này liên thông được với nhau, kích thước các lỗ to, nhỏ không đều. Bề mặt giá thể tương đối nhám, có nhiều rãnh, khe thuận lợi cho tế bào bám dính và phát triển. Hơn nữa, cấu trúc ba chiều của giá thể tạo điều kiện thuận lợi về mặt không gian, đồng thời giúp các chất dinh dưỡng được luân chuyển tốt trong quá trình nuôi cấy 11 , 12 , 13 . Do vậy, đây là một trong những giá thể sinh học rất tiềm năng trong kỹ nghệ mô. Nghiên cứu này sử dụng chính fibrin để tăng sự kết dính của phức hợp tế bào và giá thể fibrin lên mô và kết quả cho thấy các tế bào trong phức hợp này được hỗ trợ tăng sinh và phát triển tốt hơn. Kết quả này có thể đưa đến ứng dụng tương lai khi sử dụng fibrin tự thân trong liệu pháp tái tạo nội mạc tử cung.
Estrogen, một trong những hormone sinh dục chính yếu của nữ giới, có vai trò làm nội mạc tử cung dày lên, do sự tích trữ nước và chất dinh dưỡng bên trong tế bào chất của các tế bào lớp nội mạc, đồng thời làm các ống tuyến phát triển dài và thẳng 14 , 15 . Bên cạnh đó, estrogen còn có nhiệm vụ tạo các mạch máu mới ở lớp chức năng để tăng lượng máu đến lớp nội mạc, kích thích sự phát triển của lớp nội mạc. Estrogen có thể làm tăng số lượng tế bào trong quá trình tổn thương nội mạc tử cung và thúc đẩy quá trình tái tạo nội mạc tử cung 16 . Trong thí nghiệm này, estrogen được sử dụng như một yếu tố kích thích sự tăng sinh tế bào nhằm mô phỏng môi trường sinh lý của nội mạc tử cung trong cơ thể. Mặc dù kết quả nghiên cứu này đã xác định được vai trò tái tạo nội mạc tử cung của sản phẩm kết hợp tế bào gốc và giá thể fibrin trong sự hiện diện của estrogen nhưng cấu trúc nội mạc tử cung sau liệu pháp tái tạo vẫn chưa hoàn thiện sau 14 ngày điều trị. Cụ thể, các tế bào biểu mô nội mạc tử cung đã không hiện hiện do đó không thể bảo toàn được cấu trúc phân lớp nội mạc tử cung như trong cơ thể. Nguyên nhân dẫn đến hiện tượng này có thể là do không gian điều kiện nuôi cấy (nuôi cấy ngập mảnh mô trong môi trường nuôi cấy) không phù hợp cho sự phát triển của biểu mô nội mạc tử cung. Do đó, để hỗ trợ tốt hơn cho mô hình nghiên cứu tái tạo nội mạc tử cung in vitro , cần thiết thiết kế một điều kiện nuôi đảm bảo cho sự phát triển của từng cấu trúc phân lớp, thí dụ nuôi cấy sao cho biểu mô nội mạc tử cung có thể tương tác với không khí (air-liquid) 17 , 18 , 19 .
Nghiên cứu cần tiếp tục được cải thiện để có thể đưa ra liệu pháp điều trị phù hợp và có tiềm năng ứng dụng lâm sàng.
KẾT LUẬN
Bài báo trình bày việc đã tạo thành công mô hình mô tử cung bị mất lớp nội mạc sau 14 ngày nuôi cấy, tuy vậy, những mô tử cung này vẫn không có khả năng tái tạo lại lớp nội mạc đã bị tổn thương. Liệu pháp tác động kết hợp tế bào hADSC hoặc hBMSC với giá thể fibrin trong sự hiện diện của estrogen ở nồng độ 8x10 -4 mg/mL thúc đẩy sự tái tạo nội mạc tử cung, cấu trúc nội mạc dần được hình thành với sự hiện diện của cấu trúc giống tuyến tử cung. Kết quả của nghiên cứu góp phần cho thấy tiềm năng ứng dụng các nguồn tế bào gốc, liệu pháp hormone và vai trò hỗ trợ của giá thể trong việc hỗ trợ tái tạo lớp nội mạc tử cung.
LỜI CẢM ƠN
Nghiên cứu được tài trợ bởi Sở Khoa học và Công nghệ Thành phố Hồ Chí Minh trong khuôn khổ Đề tài mã số: 615/QĐ-SKHCN.
DANH MỤC TỪ VIẾT TẮT
hADSC Human Adipose-derived Stem Cells: Tế bào gốc từ mô mỡ người
hBMSC Human Bone Marrow Stem Cells: Tế bào gốc từ tủy xương người
hESC Human Endometrial Stem Cells: Tế bào gốc nội mạc tử cung người
hUCMSC Human Umbilical Cord Mesenchymal Stem Cells: Tế bào gốc trung mô từ dây rốn người
XUNG ĐỘT LỢI ÍCH
Các tác giả cam đoan không có xung đột lợi ích trong việc công bố bài báo này.
ĐÓNG GÓP CỦA CÁC TÁC GIẢ
Trịnh Ngọc Lê Vân, Lê Thị Bích Thảo, Huỳnh Đặng Hà Uyên thực hiện thu nhận mô, thực hiện chính thí nghiệm.
Lê Thị Vĩ Tuyết: viết bản thảo và biện luận các kết quả nghiên cứu và liên hệ gửi bản thảo.
Hoàng Thị Diễm Tuyết, Trần Lê Bảo Hà: tham gia hướng dẫn, chỉnh sửa bản thảo.
References
- Control CfD, Prevention. 2014 assisted reproductive technology national summary report. US Dept of Health Human Services. 2016. . ;:. Google Scholar
- Matoba Y, Kisu I, Sera A, Yanokura M, Banno K, Aoki D. Current status of uterine regenerative medicine for absolute uterine factor infertility. Biomedical Reports. 2019;10(2):79-86. . ;:. PubMed Google Scholar
- Li X, Lv H-F, Zhao R, Ying M-f, Samuriwo AT, Zhao Y-Z. Recent developments in bio-scaffold materials as delivery strategies for therapeutics for endometrium regeneration. Materials Today Bio. 2021:100101. . ;:. PubMed Google Scholar
- Green H, Kehinde O, Thomas J. Growth of cultured human epidermal cells into multiple epithelia suitable for grafting. Proceedings of the National Academy of Sciences. 1979;76(11):5665-8. . ;:. PubMed Google Scholar
- Langer R, Vacanti J. Advances in tissue engineering. Journal of Pediatric Surgery. 2016;51(1):8-12. . ;:. PubMed Google Scholar
- Brännström M, Johannesson L, Bokström H, Kvarnström N, Mölne J, Dahm-Kähler P, Livebirth after uterus transplantation. The Lancet Diabetes Endocrinology. 2015;385(9968):607-16. . ;:. Google Scholar
- Hellström M, Bandstein S, Brännström M. Uterine tissue engineering and the future of uterus transplantation. Annals of Biomedical Engineering. 2017;45(7):1718-30. . ;:. PubMed Google Scholar
- Simoni M, Taylor HS. Therapeutic strategies involving uterine stem cells in reproductive medicine. Current Opinion in Obstetrics Gynecology. 2018;30(3):209-16. . ;:. PubMed Google Scholar
- Cao Y, Sun H, Zhu H, Zhu X, Tang X, Yan G, Allogeneic cell therapy using umbilical cord MSCs on collagen scaffolds for patients with recurrent uterine adhesion: a phase I clinical trial. Stem Cell Research. 2018;9(1):1-10. . ;:. PubMed Google Scholar
- Ha TLB. Study on creating peripheral blood derived fibrin gel as scaffolds for human dental pulp stem cells. Tạp chí Khoa học và Công nghệ. 2015;53(3):277-86. . ;:. Google Scholar
- Ahmed TA, Dare EV, Hincke M. Fibrin: a versatile scaffold for tissue engineering applications. Tissue Engineering Part B: Reviews. 2008;14(2):199-215. . ;:. PubMed Google Scholar
- Janmey PA, Winer JP, Weisel JW. Fibrin gels and their clinical and bioengineering applications. Journal of the Royal Society Interface. 2009;6(30):1-10. . ;:. PubMed Google Scholar
- Kolehmainen K, Willerth SM. Preparation of 3D fibrin scaffolds for stem cell culture applications. JoVE. 2012(61):e3641. . ;:. PubMed Google Scholar
- Hong L, Zhang G, Sultana H, Yu Y, Wei Z. The effects of 17-β estradiol on enhancing proliferation of human bone marrow mesenchymal stromal cells in vitro. Stem Cells Development. 2011;20(5):925-31. . ;:. PubMed Google Scholar
- Zhang L, Ma Y, Liu M, Guo H, biophysics. The effects of various estrogen doses on the proliferation and differentiation of cultured neural stem cells. General Physiology. 2019;38(5):417-25. . ;:. PubMed Google Scholar
- Hyodo S, Matsubara K, Kameda K, Matsubara Y. Endometrial injury increases side population cells in the uterine endometrium: a decisive role of estrogen. The Tohoku Journal of Experimental Medicine. 2011;224(1):47-55. . ;:. PubMed Google Scholar
- Li D, Li H, Wang Y, Eldomany A, Wu J, Yuan C. Development and characterization of a polarized human endometrial cell epithelia in an air-liquid interface state. Stem Cell Research. 2018;9(1):1-7. . ;:. PubMed Google Scholar
- Muruganandan S, Fan X, Dhal S, Nayak NR. Development of a 3D tissue slice culture model for the study of human endometrial repair and regeneration. Biomolecules. 2020;10(1):136. . ;:. PubMed Google Scholar
- Prytherch Z, Job C, Marshall H, Oreffo V, Foster M, BéruBé K. Tissue‐specific stem cell differentiation in an in vitro airway model. Macromolecular Bioscience. 2011;11(11):1467-77. . ;:. PubMed Google Scholar

 Open Access
Open Access