Abstract
The innate immune system is initiated by the recognition of Pathogen-associated molecular patterns (PAMPs) through Pattern recognition receptors (PRRs). Among all the identified PRRs, the Toll-like receptors (TLRs) are the most extensive spectrum of pathogen recognition. TLR22 is a non-mammalian TLR that is found mostly in fish. In this review, we have briefly expounded on the structure and signaling pathways of TLR22 in several fish species, as well as how it kills pathogens. Similar to the other TLRs, TLR22 has a three-domain structure: the periplasmic extracellular domain (ectodomain – ECD) containing Leucine-rich repeats domain (LRR), transmembrane domain (TM), and cytoplasmic Toll/IL-1 receptor domain (TIR). The LRR motifs number, the choice of ligands, and signaling pathways are different from fish to fish. TLR22 recognizes dsRNA and LPS, signaling the immune system to kill pathogens. Currently, there are several reports of the application of TLRs, but there is no published report on the applications of TLR22. We presented several applications similar to other TLRs, suggesting new potential applications for TLR22. However, there are still many unresolved issues remaining, thus more research is needed to warrant the understanding of TLR22 functionality.
GIỚI THIỆU
Hệ thống miễn dịch là phòng tuyến vững chắc của cơ thể vật chủ chống lại sự xâm nhập của mầm bệnh, hệ thống này bao gồm miễn dịch bẩm sinh và miễn dịch thích ứng. Cá là động vật có xương sống đầu tiên sở hữu hệ thống miễn dịch thích ứng gồm các tế bào lympho, và kháng thể 1 . Tế bào lympho B là thành phần quan trọng của phản ứng miễn dịch thích ứng, với nhiệm vụ chính là sản xuất kháng thể có ái lực cao, giúp chống lại kháng nguyên ngoại lai, đồng thời hoạt động như một tế bào trình diện kháng nguyên (antigen resenting cell – APC) để trình diện kháng nguyên đã xử lý kích hoạt tế bào T. Tế bào lympho T là yếu tố chính của miễn dịch thích ứng. Thụ thể tế bào T (T cell receptor – TCR) luôn được liên kết màng, và được kích thích thông qua tương tác với kháng nguyên do APC trình diện. Hệ miễn dịch bẩm sinh không chỉ hoạt động như tuyến phòng thủ đầu tiên chống lại tất cả các tác nhân gây bệnh, mà còn đóng vai trò hỗ trợ hoạt hoá đáp ứng miễn dịch thích ứng. Các yếu tố của thành phần miễn dịch bẩm sinh bao gồm peptide kháng khuẩn, lysozyme, lectin, và hệ thống bổ thể. Hệ miễn dịch bẩm sinh nhanh chóng được kích hoạt khi gặp “các tín hiệu nguy hiểm” có trên vi sinh vật gây bệnh, điều này là cần thiết vì cơ thể sinh vật cần được bảo vệ cho đến khi miễn dịch thích ứng được kích hoạt. Ở cá, hệ thống miễn dịch bẩm sinh chiếm ưu thế trong việc chống lại sự xâm nhiễm của mầm bệnh, điều này do hạn chế về lượng kháng thể ở miễn dịch thích ứng 2 . Là sinh vật biến nhiệt, do đó nhiệt độ môi trường nước ảnh hưởng trực tiếp đến thân nhiệt của cá, sự “stress” nhiệt độ này cũng hạn chế khả năng miễn dịch thích ứng 3 . Một điều thú vị khác ở hệ thống miễn dịch của cá là khả năng thực bào của tế bào lympho B, điều này cho thấy vai trò chưa được biết trước đây của tế bào B trong hệ thống miễn dịch bẩm sinh 4 .
Figure 1 . Hệ miễn dịch bẩm sinh, và miễn dịch thích ứng ở cá 5
Miễn dịch bẩm sinh ở cá thường được chia thành 3 thành phần: hàng rào vật lý, thành phần dịch thể, và thành phần tế bào ( Figure 1 ). Hàng rào vật lý bao gồm vảy cá, lớp chất nhờn, các tế bào biểu mô của da, mang, và ống tiêu hóa. Khi mầm bệnh vượt qua các rào cản vật lý, chúng sẽ gặp phải sự cản trở của thành phần dịch thể, và thành phần tế bào của hệ miễn dịch bẩm sinh. Các thành phần dịch thể bao gồm transferrin, peptide kháng khuẩn, lysozyme, lectin, kháng thể tự nhiên, và các cytokine. Thành phần tế bào của hệ miễn dịch bẩm sinh ở cá có đại thực bào, bạch cầu trung tính, tế bào NK, v.v 6 . Các thành phần này có vai trò ức chế sự phát triển, hay giết chết vi sinh vật.
Figure 2 . Nhận diện PAMP, và con đường truyền tín hiệu đơn giản của các TLR. TLR cảm nhận được PAMP có nguồn gốc từ vi khuẩn (LTA, LPS), virus (vật chất di truyền), nấm, và truyền tín hiệu để kích hoạt các phân tử tín hiệu bên dưới sau khi hoạt hóa cytokine và interferon (IFN) 7
Phản ứng miễn dịch bẩm sinh bắt đầu khi các thụ thể nhận dạng kiểu mẫu (pattern recognition receptors – PRRs) của các tế bào miễn dịch ở vật chủ nhận ra các kiểu mẫu phân tử đặc trưng trên mầm bệnh (pathogen-associated molecular atterns – PAMPs) ( Figure 2 ). Các PAMPs thường thấy bao gồm: lipopolysaccharid, RNA sợi đôi (dsRNA), đường mannose trên glycoprotein của vi khuẩn, và DNA vi khuẩn. Trong đó, lipopolysaccharid là nội độc tố, là thành phần quan trọng ở màng ngoài của vi khuẩn Gram âm, phân tử này có thể tạo ra phản ứng miễn dịch mạnh và các phản ứng sinh học khác nhau 8 . DsRNA là vật chất di truyền của nhóm virus RNA sợi đôi, và cũng là chất trung gian của quá trình sao chép của nhóm virus RNA sợi đơn dương, hay nhóm virus có vật chất di truyền là DNA. DsRNA có thể kích thích các phản ứng miễn dịch trong tế bào chủ 9 . DNA của vi khuẩn có các vị trí CpG không được methyl hóa, là khác biệt so với động vật có xương sống, cũng kích thích hệ miễn dịch nhận diện và đáp ứng từ vật chủ 10 .
Mọi PRRs đều có hai miền chức năng là miền nhận biết PAMPs đặc hiệu và miền truyền tín hiệu để kích thích đáp ứng miễn dịch 11 . Ở cá, các PRRs quan trọng bao gồm: các thụ thể nội bào ucleotide-binding oligomerization domain (NOD), hay NOD-like receptor các thụ thể nội bào nhận biết tác nhân gây bệnh do virus retinoic acid inducible gene I‑like receptors các thụ thể nhận biết β-glucan kích thích miễn dịch C‑type lectin receptor và một PRRs quan trọng là Toll-like receptor (TLR). TLR phân bố trên bề mặt hoặc trong tế bào chất của các tế bào miễn dịch, có khả năng nhận diện đặc hiệu PAMPs trên vi sinh vật gây bệnh, từ đó kích thích các phản ứng miễn dịch chống lại mầm bệnh 12 , 13 , 14 .
Cho đến nay, đã có 13 loại TLR được xác định ở động vật có vú, và hơn 20 loại TLR được xác định ở cá. Theo các nghiên cứu, số TLR được tìm thấy trên người là 10 (TLR1-10), ở chuột là 12 (TLR1-9 và TLR11-13), và có hơn 20 loại TLR được tìm thấy ở cá (TLR1-5, 7, 8, 9, 13, 14, 18-26) 15 , 16 . Sự khác biệt giữa các TLR có thể do môi trường sống khác nhau, các mầm bệnh khác nhau, dẫn đến sự biểu hiện các gen cũng khác nhau 17 . Trong hơn 20 loại ở cá, TLR22 là một trong số những TLR chỉ tồn tại ở cá mà không xuất hiện ở động vật có vú. Cho đến nay, TLR22 đã được nghiên cứu trên nhiều loài cá như: cá bơn Nhật, cá hồi vân, cá lù đù vàng, cá trắm cỏ, cá mú đốm cam, cá da trơn, cá nóc, cá mú mè, cá chép Nam Á, cá tráp đầu vàng 18 , 19 , 20 , 21 , 22 , 23 , 24 . Trong tổng quan này, chúng tôi sẽ thảo luận về cấu trúc, chức năng và tiềm năng ứng dụng của TLR22 ở cá.
CẤU TRÚC TLR22
TLR là họ các thụ thể xuyên màng loại I, và TLR22 cũng không ngoại lệ. Đa số các TLR22 ở các loài cá được cấu tạo bởi ba vùng chính: vùng ngoại bào (ectodomain - ECD) bao gồm nhiều motif giàu leucine lập lại (leucine-rich repeat – LRR), thứ hai là vùng xuyên màng (transmembrane – TM), và cuối cùng là vùng truyền tín hiệu (Toll/interleukin-1 – TIR) ( Figure 3 ) 21 , 22 . Tuy nhiên, theo nghiên cứu của Samanta và cộng sự (2014), không tìm ra vùng TM ở TLR22 của cá trôi Ấn Độ 25 .
Figure 3 . Cấu trúc ba phần của TLR22 ở cá ngựa vằn 7
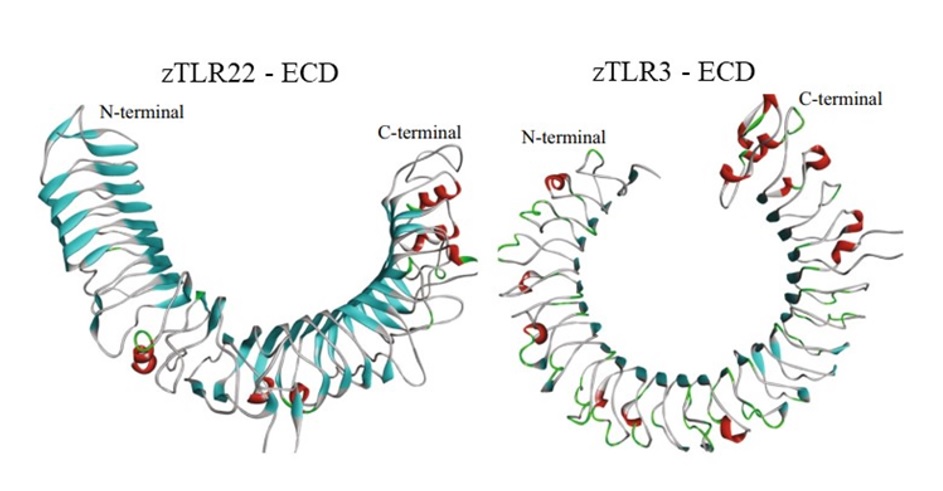
Số lượng lặp lại của các motif LRR ở ECD là khác nhau ở các loài cá, con số cụ thể ở các loài cá nóc là 16 26 , cá chày mắt đỏ là 18 27 , cá trắm cỏ có 18 21 , cá vây có 25-26 28 , và cá mú đốm cam có 17 22 . Ở các loài cá nước mặn, vùng LRR có độ tương đồng cao, trong khi độ tương đồng ở vùng LRR các loài nước ngọt thấp hơn 22 . Mô hình ECD của TLR22 ở cá tương đồng với TLR3 ở người. Chúng có cấu trúc như hình móng ngựa, với các phiến β song song được nối với nhau ở bề mặt lõm, và các xoắn α ở bề mặt lồi ( Figure 4 ) 29 , 30 . Một nghiên cứu ở cá chày mắt đỏ thuộc họ cá chép cho thấy vùng LRR có 15 phiến β, và 9 xoắn α 27 . ECD có các cụm cysteine ở hai đầu, được ký hiệu là LRRNT (phía trên), và LRRCT (phía dưới). Trong khi LRRNT có sự khác nhau giữa các TLR thì LRRCT được bảo tồn 31 .
Figure 4 . Mô hình vùng ngoại bào ECD của TLR22, và TLR3 ở cá ngựa vằn. Các phiến β được hiển thị dưới dạng màu xanh da trời, xoắn α được thể hiện dưới dạng màu đỏ, và các vòng loop là màu xám 30
Vùng chức năng TIR là vùng ít biến đổi, cấu trúc được bảo tồn cao ở các TLR, với sự tương đồng giữa cá nước ngọt và nước mặn là khá cao. Vùng này 22 . Cấu trúc tinh thể vùng TIR của TLR22 chưa được báo cáo, tuy nhiên vùng TIR ở các TLR nói chung gồm 1 tấm β có các sợi β song song ở giữa (βA, βB, βC), và các vòng xoắn α xung quanh (αA, αB, αC), cùng với các vòng loop được đặc tên theo hai cấu trúc mà chúng kết nối, ví dụ vòng loop AB kết nối chuỗi αA và sợi βB, vòng loop BB kết nối chuỗi xoắn αB và sợi βB 32 , 33 , 34 , 35 . TIR có ba vùng trình tự bảo tồn được quan tâm là: box 1, box 2, và box 3 ( Figure 5 ) 21 , 28 .
Figure 5 . Kết quả sắp giống cột trình tự vùng TIR của TLR22 ở các loài cá khác nhau 21
CHỨC NĂNG TLR22
Như đã được đề cập ở phần trên, TLR22 là thụ thể ở đại thực bào, có khả năng nhận diện LPS hoặc dsRNA trên vi sinh vật gây bệnh, từ đó truyền tín hiệu vào trong tế bào để kích thích hệ miễn dịch ở vật chủ chống lại mầm bệnh. Ở cá vây và cá trắm cỏ, TLR22 khu trú bên trong tế bào, điều này là trái ngược với TLR22 khú trú trên bề mặt tế bào ở cá nóc, và cá tuyết 24 , 26 , 28 , 36 , 37 . Ở nhiều loài cá, TLR22 được chứng minh là phản ứng với LPS 22 , 25 , 38 , 39 , nhưng đối với loài cá nóc và cá vây, TLR22 lại không có phản ứng với LPS 26 , 28 . Tuy nhiên, vẫn chưa có nghiên cứu nào cụ thể về cơ chế nhận diện LPS của TLR22.
Ngoài nhận diện và phản ứng với LPS, TLR22 còn cho thấy khả năng nhận diện dsRNA 22 , 25 . Nhiều nghiên cứu chỉ ra rằng TLR22 phản ứng với một chất tổng hợp mô phỏng dsRNA là olyinosinic acid: olycytidylic acid (poly(I:C)), điều này xuất hiện ở cá đù vàng lớn, cá trôi Ấn Độ, cá nóc, cá trăm cỏ hay cá ngựa vằn và cá tuyết 19 , 22 , 25 , 26 , 30 , 36 , 40 . Việc gây đột biến trong vùng LRR của TLR22 ở cá trôi Ấn Độ đã ảnh hưởng đến khả năng liên kết với poly(I:C) 41 . Các kết quả trên cho thấy TLR22 có chức năng nhân diện và tương tác với dsDNA và chức năng này được bảo tồn giữa các loài cá khác nhau. Trong TLR nói chung, các motif LRR khác nhau có vai trò nhận diện các PAMPs khác nhau 25 . Ở TLR22, sự đa dạng về số lượng motif LRR ở các loài cá dẫn đến sự đa dạng về vị trí nhận diện. Ở cá trôi Ấn Độ, vùng LRR11-13 cho thấy sự hoạt động tối đa khi tác nhân kích thích là poly(I:C), điều này gợi ý rằng LRR11-13 có thể là vùng quan trọng nhận dạng dsRNA ở TLR22 25 , 40 . Tuy nhiên, ở cá ngựa vằn vùng LRRNT‑LRR3 và LRR22-LRR24 trong TLR22 được xác định là các vùng LRR quan trọng để nhận ra dsRNA 31 . Ở cá tuyết, TLR22 có vùng LRR22 hình thành phần nhô ra bên ngoài tương tự như LRR20 của TLR3 ở người. Đồng thời LRR11 hình thành một chuỗi xoắn α đều đặn rất lớn và nhô ra bên ngoài tương tự như LRR12 của TLR3 ở người, mà vùng LRR12 và LRR20 là hai vùng nhận diện dsRNA của TLR3. Do đó, Sundaram và cộng sự nhận định rằng vùng LRR22 và LRR11 của TLR22 ở cá tuyết có thể là vùng quan trọng để nhận diện dsRNA 29 , 42 .
Vùng ECD của TLR22 có dạng hình cung như hình móc câu (hình móng ngựa), sợi poly(I:C) liên kết tại hai đầu cuối ở phía bên trong vòng cung của ECD ( Figure 6 ). Sợi cytidine của poly(I:C) tương tác với các tấm β thông qua các liên kết hydro và dẫn xuất purine hypoxanthine đã được chứng minh là tránh xa bề mặt của thụ thể. Ở cá nóc, TLR22 được chứng minh nhận diện dsRNA có kích thước đến 1000 bp. Cách thức để TLR22 nhận diện dsRNA ở loài cá xương (teleost) chưa được xác định 26 . Tuy nhiên theo mô tả của Bikash Ranjan Sahoo và cộng sự, vùng LRR của TLR22 ở cá ngựa vằn chứa nhiều axit amin dương (96 aa) hơn axit amin âm (79 aa). Với giá trị pI là 8,89, có thể liên kết tĩnh điện đã xuất hiện giữa LRR với dsRNA tích điện âm 30 .
Figure 6 . Tương tác phân tử của poly(I:C) và TLR22 ECD. A, đầu N của mô hình TLR22 - ECD. B, đầu C của mô hình TLR22 - ECD. Các liên kết hydro được hiển thị dưới dạng các đường chấm, phối tử như hình gậy 30 .
Đối với TLR3 của người, vùng LRRCT cần thiết cho sự hình thành dimer, quá trình này được thực hiện qua trung gian tiếp xúc giữa hai vùng LRRCT của hai thụ thể TLR3. Các vị trí hình thành dimer này ở TLR3 ảnh hưởng trực tiếp đến khả năng liên kết dsRNA 43 , 44 . Vùng TM thuộc TLR2 ở người có tương tác mạnh mẽ với TLR1, TLR6, TLR10, và không tương tác với các thụ thể xuyên màng khác 45 , 46 . Các tương tác ở LRRCT hay TM giống TLR3 của người đã được quan sát ở TLR3 của cá ngựa vằn, nhưng chưa có báo cáo nào về sự tương tác này ở TLR22 30 . Vì vậy chức năng của vùng LRRCT, và TM của TLR22 hiện nay chưa được làm rõ.
Như đã ghi nhận ở phần trên, vùng TIR được bảo tồn cao trong TLR22 ở các loài cá, với ba motif hoạt động: box 1, box 2, box 3. Trong đó, box 1, và box 2 là trung gian liên kết với các phân tử cầu nối của con đường dẫn truyền tín hiệu, box 3 tham gia vào việc định hướng sự khu trú của các thụ thể trên bề mặt hay bên trong tế bào 21 , 22 , 28 , 47 .
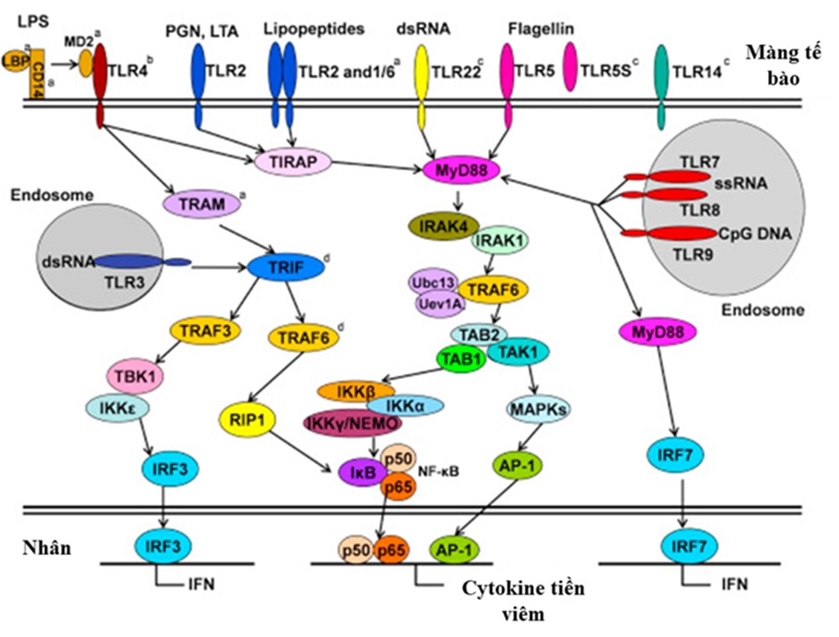
Figure 7 . Con đường truyền tín hiệu của các TLR ở cá xương 48
TLR truyền tín hiệu nội bào chủ yếu qua hai con đường là phụ thuộc MyD88 (Myeloid differentiation rimary response rotein 88) và TIR domain-containing adaptor inducing IFN‑β (TRIF) ( Figure 7 ) 49 . Khi TLR nhận diện và liên kết PAMP, MyD88 sử dụng vùng death domain (DD) tương tác với protein kinase 4 (IRAK4) 50 . Sau đó, phức hợp MyD88-IRAK4 kích hoạt IRAK1. IRAK1 tách khỏi MyD88 và tương tác với ligase ubiquitin E3 (TRAF6 –TNFR‑associated factor 6). TRAF6 xúc tác sự hình thành chuỗi polyubiquitin liên kết lysine 63 trên chính TRAF6, và dẫn đến sự tự động ubiquitin hóa TRAF6 với sự trợ giúp của phức hợp enzyme liên hợp ubiquitin E2 bao gồm Ubc13, và Uev1A. Sau đó, TRAF6 tương tác với phức hợp TGF-β-activated kinase 1 (TAK1) nhờ protein liên kết TAK1: TAB2, TAB1 giúp kích hoạt TAK1. Thông qua IKKβ được phosphoryl hóa, TAK1 ở trạng thái hoạt động sẽ kích hoạt phức hợp IκB kinase (IKK), bao gồm IKKα, IKKβ và IKKγ/(NEMO). Sau đó, IKKβ phosphoryl hóa các protein liên kết với NF-κB: IκB, làm ngăn chặn sự chuyển IκB vào nhân, dẫn đến sự phá hủy IκB và giúp cho sự chuyển các tiểu đơn vị p50, p65 của NF-κB vào nhân, tham gia vào quá trình phiên mã các gen cho các cytokine như TNF‑α , IL‑6 , IL‑8 và IL‑12 51 , 52 . Ngoài NF‑κB, phức hợp AP‑1 cũng được kích hoạt theo con đường phụ thuộc MyD88 thông qua mitogen activated rotein kinase (MAPK) được phosphoryl hóa làm kích hoạt các gen cytokine mục tiêu 53 . Một điều thú vị là TLR7, 8, 9 kích hoạt con đường MyD88 theo một cách khác để tạo các IFN loại I 48 .
Con đường truyền tin hiệu qua TLR không phụ thuộc MyD88 với adaptor là TRIF, hay còn gọi là Toll-like receptor adaptor molecule 1 (TICAM‑1). TRIF kích hoạt NF-κB liên kết với TANK‑ inding kinase 1 (TBK1) thông qua TRAF3 54 . Sau đó, TRAF3, TBK1, và IKKε phosphoryl hóa IRF3. IRF3 được dimer hóa, và được vận chuyển vào nhân, biểu hiện protein của IFN loại I 55 . Ngoài ra, TRIF của động vật có vú cũng tương tác với TRAF6, và receptor‑interacting protein 1 (RIP1), chịu trách nhiệm kích hoạt NF-κB 56 . Tuy nhiên, TRIF không thể tương tác với TRAF6 trong cá ngựa vằn. Do đó ở cá, sự hoạt hóa NF-κB phụ thuộc vào sự tương tác của nó với RIP1 thông qua một cơ chế không xác định 57 . Ở cá vây và cá mú đốm cam, TLR22 có thể sử dụng cả cầu nối MyD88 và TRIF, do đó có thể kích hoạt cả hai đường truyền tín hiệu 22 , 28 . Tuy nhiên, cá mú đốm cam có thể cân bằng quá trình viêm bằng cách ngăn chặn con đường tín hiệu NF-κB, và kích hoạt chọn lọc con đường tín hiệu MAPK. Ở cá trắm cỏ, TLR22 chỉ có đường truyền tín hiệu phụ thuộc MyD88, ngược với cá nóc chỉ truyền tín hiệu qua TIRF 26 , 37 .
Ở mỗi loài cá khi có kích thích của dsRNA hay LPS thì sự biểu hiện gen TLR22 trong các mô là khác nhau. TLR22 biểu hiện chủ yếu trong lá lách của cá vây, cá vàng và cá hồi; trong gan, thận, lá lách, và mang ở cá bơn Nhật Bản, cá nóc; và ở mang đối với cá trắm cỏ 18 , 20 , 26 , 28 , 58 . Sự biểu hiện của gen TLR22 chiếm ưu thế trong các mô liên quan đến miễn dịch, chẳng hạn như lá lách, thận, và mang. Điều này cho thấy rằng TLR22 có vai trò quan trọng trong hệ thống miễn dịch ở cá chống lại virus hay vi khuẩn gây bệnh. Dù khác nhau về phối tử (dsRNA, hoặc PLS, hoặc cả hai) hay đường truyền tín hiệu, TLR22 đều sẽ tạo ra IFN-I, hay các cytokine gây viêm.
IFN-I ức chế sự sao chép và lây nhiễm của vi rút thông qua việc sản xuất các IFN‑ timulated gene (ISG). IFN-I liên kết với interferon-α/β receptor (IFNAR), kích hoạt Janus kinase 1 (JAK1), và tyrosine kinase 2 (TYK2), các yếu tố này kích hoạt STAT1, và STAT2 (signal transducer and activator of transcription). Các STAT được kích hoạt tạo thành một heterodimer, và sử dụng IFN9 để tạo ra một phức hợp STAT1-STAT2-IRF9 59 . Phức hợp này chuyển vào nhân và kích hoạt các gen ISG ( Figure 8 ). Tương tự như ở động vật có vú, ISG của cá bao gồm protein Mx và ISG15 60 . Ở động vật có vú, protein Mx ức chế sự nhân lên của virus thông qua tương tác với cấu trúc nucelocapsid. Tuy nhiên, protein Mx ở cá ức chế sự tổng hợp RNA của virus bằng cách tương tác, và vận chuyển RNA-dependent RNA olymerase đến vùng tế bào chất để tiêu hủy 61 . Trong các báo cáo về cá hồi Đại Tây Dương và cá bơn Nhật Bản, protein Mx ức chế sự nhân lên của vi rút gây hoại tử tuyến tụy (IPNV - infectious pancreatic necrosis virus) và virus rhabdovirus 62 , 63 . ISG15 là một protein tương tự ubiquitin và gắn vào các protein đích thông qua motif Gly-Gly ở đầu C 64 . Các hoạt động kháng virus của ISG15 đã được chứng minh ở cá vàng, cá ngựa vằn, và cá mú đốm cam 64 , 65 , 66 .
Đường truyền tín hiệu phụ thuộc MyD88 còn tạo ra các cytokine gây viêm như interleukin‑1 (IL-1) và TNF-α 22 . Phản ứng viêm ở cá thực hiện theo quy trình hai bước: tăng biểu hiện các cytokine và kích hoạt hình thành thể viêm để phân cắt các cytokine thành các dạng hoạt động của nó. Sự giải phóng TNF-α hòa tan đòi hỏi phải loại bỏ vùng tiền chất bao gồm vùng đầu N và vùng xuyên màng 68 . Sau khi ở trạng thái hoạt động, các cytokine gây viêm của cá có tác dụng kích thích miễn dịch tương tự như ở động vật có vú 69 , 70 . Ở động vật có vú, cần có sự kích hoạt enzym chuyển đổi interleukin caspase-1 để xử lý IL-1 71 . Tuy nhiên quá trình này vẫn còn nhiều tranh cãi ở cá, cụ thể là ở vị trí cắt của enzyme trên IL-1 72 .
ỨNG DỤNG
Hiện nay, chưa có báo cáo nào về ứng dụng TLR22 trong điều trị bệnh cho cá. Chúng tôi sẽ trình bày một số ứng dụng TLR kháng virus gây bệnh ở cá và một số động vật khác có thể là tiền đề để phát triển các ứng dụng của TLR22 trong tương lai. Kháng mầm bệnh dựa vào TLR là một lĩnh vực đang được quan tâm nghiên cứu. Có nhiều nghiên cứu sử dụng chất giả lập như một tác nhân kích thích TLR tạo ra tín hiệu kháng khuẩn, trong đó, chất giả lập là một chất tổng hợp mô phỏng phối tử của TLR nhằm kích thích con đường tuyền tín hiệu.
Oligodeoxynucleotide (ODN) có chứa dinucleotide CpG chưa được methyl hóa trong các motif CpG (CpG ODN) tương tự với DNA của vi khuẩn hoặc virus (CpG DNA). Đây là tín hiệu được hệ thống miễn dịch nhận diện là nguy hiểm ở động vật có xương sống chủ yếu thông qua TLR9 73 . Một số nghiên cứu chỉ ra rằng CpG ODN đã kích thích tạo ra các cytokine giống IFN ở cá cá hồi, sản xuất interleukin-1 ở cá hồi vân, tăng khả năng đề kháng của cá bơn khi bị nhiễm vi khuẩn gây bệnh Edwardsiella tarda 74 , 75 . Ngoài ra, CpG ODN đã được chứng minh là chất tăng cường miễn dịch, bổ trợ cho chống herpesvirus 1 ở bò 76 . CpG ODN cũng được chứng minh có khả năng tăng cường sức đề kháng của chuột khi nhiễm virus herpes implex type 2 (HSV-2), là tiền đề để phát triển thuốc chống virus HSV-2 ở nữ 77 .
DsRNA tổng hợp (poly(I:C)) là chất giả lập quen thuộc của TLR3 và TLR22. Khi sử dụng poly(I:C), cá hồi Đại Tây Dương đã tạo được sự đề kháng chống lại virus Infectious almon anaemia (ISAV) gây bệnh thiếu máu. Khi kiểm tra sự biểu hiện của các thụ thể liên quan, TLR3 biểu hiện cao ở các mô miễn dịch như ruột và lá lách, trong khi đó TLR22 không được biểu hiện 78 , 79 . Chất giả lập cổ điển của TLR3 là poly(I:C), tuy nhiên poly(I:C) đã gây ra dị ứng, suy thận, và rối loạn đông máu ở các nghiên cứu trên người, một chất giả lập TLR3 khác được tổng hợp với việc bổ sung các gốc uracil và guanosine tạo ra poly(I:C12U) làm loại bỏ các triệu chứng trên 80 , 81 . Poly(I:C12U) tiêm tĩnh mạch được sử dụng trong các thử nghiệm ban đầu để nghiên cứu khả năng điều trị cho bệnh nhân nhiễm HIV (human immunodeficiency virus) 82 .
Imiquimod là một chất giả lập của TLR7, kích thích TLR7 sau đó hoạt hóa yếu tố NF-κB và cảm ứng các cytokine, chemokine như: INF-α, TNF-α, IL-1α, IL-1β, IL-1, IL-6…, có tác dụng điều trị mụn cóc ở cơ quan sinh dục và quanh hậu môn do nhiễm virus HPV (human apillomavirus) 83 , 84 . Tuy nhiên, protein E6 và E7 của virus HPV đã được báo cáo là ức chế mạnh sự hoạt hóa NF-κB, có thể làm giảm hiệu quả của imiquimod 85 . Ở cá, imiquimod cũng tạo ra các phản ứng miễn dịch khi kích thích mạnh mẽ các IL-1b, IL-6, IL-8, IL-10, IFN-a1, IFN-c, và Mx 79 . Resiquimod ([4-amino-2-(ethoxymethyl) imidazo [4, 5-c] quinolin-1-yl]-2-methylpropan-2-ol) đã được thử nghiệm bằng đường uống. Resiquimod có cấu trúc tương tự và kích thích các phản ứng miễn dịch thông qua TLR 7 như imiquimod, đồng thời resiquimod cũng kích thích TLR 8 86 . Resiquimod cũng được dùng để điều trị nhiễm virus viêm gan C (hepatitis C virus), nhưng tác dụng kháng virus thấp và không đươc duy trì 87 .
Các chất giả lập của TLR2, 4, 7, 21 ở gà, lần lượt là Pam3CSK4, LPS, R848, và CpG OND 88 , 89 , cho thấy khả năng kháng virus gây cúm gia cầm AIV (avian influenza virus). Trong đó, CpG OND là hiệu quả nhất để giảm sự tăng sinh virus ở miệng gà, LPS giảm sự phát tán virus được ghi nhận ở hậu môn. Các chất giả lập này đều gây ra sự biểu hiện của các gen liên quan đến cảm kháng virus 90 . Như vậy, dựa trên các ứng dụng của TLR của các động vật khác, việc thử ứng dụng TLR22 trong chống lại virus hay vi khuẩn gây bệnh có ý nghĩa rất lớn với ngành nuôi cá nói riêng và ngành nuôi trồng thủy sản nói chung.
Nhìn chung, các ứng dụng ở TLR sử dụng chất giả lập để kích thích hệ thống miễn dịch ở vật chủ, nhắm tới tiêu diệt tác nhân gây bệnh. Tương tự như các TLR khác, TLR22 cũng có thể hướng đến sử dụng LPS hay poly (I:C) để tăng khả năng chống lại vi khuẩn gây bệnh trên cá. Tuy vậy, chúng tôi mong muốn hướng đến ứng dụng mang tính mới mẻ hơn cho TLR22 là tạo “bẫy” bắt sinh học. Dựa trên cấu trúc và chức năng của từng phần TLR22 đã thảo luận ở phần trên, việc tạo “bẫy” sinh học dựa trên phần ECD của TLR22 là có thể thực hiện. Mặc khác, vẫn chưa có nhiều hiểu biết về cấu trúc cũng như chức năng cụ thể của các vùng LRR hay cơ chế liên kết với LPS, dsRNA của thụ thể TLR22. Khi việc tạo “bẫy” của TLR22 thành công, không những có thể ứng dụng để phòng bệnh cho cá, mà có thể sẽ là tiền đề quan trọng cho các nghiên cứu chi tiết hơn về cấu trúc và chức năng của TLR22 ở cá trong tương lai.
Ngày nay, việc sử dụng các thụ thể để “bẫy” các nhân tố gây bệnh đã nổi lên như một liệu pháp mới trong việc phòng và điều trị bệnh. Ở tôm, lectins đã được xác định là một tác nhân quan trọng trong hệ thống miễn dịch 91 . L-type lectin và C-type lectin ở tôm thẻ chân trắng Litopenaeus vannamei đã được chứng minh có sự hỗ trợ miễn dịch chống lại vi khuẩn Vibrio parahaemolyticus gây bệnh gan tụy cấp (AHPND) 92 . Protein tái tổ hợp L-type lectin và C‑type lectin từ L. vannamei dạng tan đa được biểu hiện thành công ở vi khuẩn E. coli có thể kết dính với V. parahaemolyticus đã mở ra tiền đề cho ứng dụng điều trị bệnh gan tụy cấp ở tôm 93 . Ở người, SCARB2 là thụ thể xâm nhiễm của enterovirus 71 (EV71) gây bệnh tay chân miệng 94 . Nhóm nghiên cứu Võ Nguyễn Hải Vy và cộng sự đã biểu hiện thành công thụ thể SCARB2 của người dạng hòa tan trong hệ thống biểu hiện E. coli, và xác nhận sự gắn kết giữa thụ thể SCARB2 tái tổ hợp với EV71 thông qua ELISA gián tiếp, mở ra tiềm năng ứng điều trị bệnh tay chân miệng cho trẻ em 95 . Nhìn chung, các ứng dụng biểu hiện thụ thể của virus để “bẫy” chúng đã và còn đang được nghiên cứu, nhưng sẽ thật thú vị nếu có sự tham gia của “gia đình” thụ thể TLR, đặc biệt là TLR22.
Cá là thực phẩm có giá trị dinh dưỡng cao, giá trị kinh tế cao. Sự phát triển của ngành nuôi trồng thủy hải sản đang gặp phải nhiều khó khăn, đặc biệt là dịch bệnh. Khi cá bị bệnh, người dân chủ yếu dựa vào kháng sinh, điều này gây ra nhiều lo ngại về tình trạng kháng kháng sinh, cũng như sức khỏe người tiêu dùng. Ngoài kháng sinh, việc sử dụng vaccine cho cá tra cũng là vấn đề đang được quan tâm 96 . Tuy nhiên, phương pháp tiêm hay ngâm cá giống trong vaccine gặp nhiều vấn đề về phân phối thuốc ở các giai đoạn phát triển của cá 96 , 97 , 98 . Bên cạnh đó, vaccine uống tạo miễn dịch dịch thể không mạnh mẽ và khó khăn trong quá trình bảo quản, vận chuyển xa 97 . Vì vậy, việc tìm ra các giải pháp mới để trị bệnh cho cá là điều cần thiết. Từ những ứng dụng đã đề cập ở trên, “bẫy” sinh học dựa trên các thụ thể TLR là một hướng nghiên cứu giàu tiềm năng. Chúng tôi đề xuất việc biểu hiện các vùng ECD của TLR ở dạng tan có hoạt tính giúp tăng khả năng cạnh tranh liên kết với vi khuẩn hoặc virus gây bệnh. Ngoài ra việc biểu hiện vùng ECD của TLR trên bề mặt một hệ thống mang có thể “bắt giữ” các tác nhân gây bệnh trên bề mặt. TLR22 là thụ thể nhận diện các kiểu mẫu phân tử như lipopolysaccharide ở vi khuẩn, hay dsRNA ở virus. Điều này giúp “bẫy” TLR22 cho phổ tác động rộng và đa dạng hơn so với các receptor nhận diện thụ thể đặc hiệu. Hiện nay chưa có công bố nào về ứng dụng của TLR tham gia trực tiếp “bắt” hay “bẫy” vi sinh vật gây bệnh ở cá. Mặc dù còn nhiều khó khăn ở phía trước, nhưng “bẫy TLR22” sẽ là một hướng nghiên cứu mang tính đột phá, tác động tích cực đến sự phát triển của ngành chăn nuôi thủy hải sản trong và ngoài nước.
KẾT LUẬN
TLR22 là một TLR đặc trưng có ở cá nhưng không phát hiện trên động vật có vú, có thể là một nhân tố đặc biệt và có chức năng quan trọng trong hệ thống miễn dịch của cá. Với cấu trúc được cấu tạo bởi ba phần chính tương tự như các TLR khác, TLR22 có khả năng nhận diện PAMPs trên vi sinh vật gây bệnh, từ đó truyền các tín hiệu bên dưới để kích thích hệ miễn dịch tiêu diệt mầm bệnh. Tuy nhiên, đặc điểm cấu tạo chi tiết từng vùng của TLR22 là khác nhau giữa các loài cá, dẫn đến việc nhận diện PAMPs và con đường truyền tín hiệu cũng khác nhau. TLR22 được chứng minh nhận diện LPS hoặc dsRNA trên vi sinh vật gây bệnh, truyền tín hiệu theo con đường phụ thuộc MyD88 hoặc không phụ thuộc MyD88 hoặc cả hai. Trong tổng quan này, chúng tôi đã tổng hợp, trình bày sơ lược về các đường truyền tín hiệu, cũng như cách chúng tiêu diệt mềm bệnh. Tuy nhiên, nhiều vấn đề chưa được hiểu rõ và cần thêm nhiều nghiên cứu để hoàn thiện sự hiểu biết về TLR22. Về hướng ứng dụng của TLR, đặc biệt là TLR22 trong điều trị bệnh cho cá hiện nay còn rất hạn chế. Ở người, và các động vận khác, những ứng dụng TLR chủ yếu xoay quanh chất giả lập và vẫn còn gặp nhiều khó khăn trong con đường truyền tín hiệu, cũng như sự lẫn tránh hệ miễn dịch của vi sinh vật gây bệnh. Cuối cùng, chúng tôi hy vọng tương lai có thêm nhiều nghiên cứu về cấu trúc, chức năng, và con đường truyền tín hiệu của TLR22 được thực hiện, để có thêm nhiều ứng dụng của chúng đối với ngành nuôi cá nói riêng và nuôi trồng thủy sản nói chung.
DANH MỤC CÁC TỪ VIẾT TẮT
AHPND: Acute Hepatopancreatic Necrosis Disease
APC: Antigen Presenting Cell
CpG: Unmethylated Cytosine–guanine Dinucleotide
DNA: Deoxyribonucleic Acid
dsRNA: Double-stranded Ribonucleic Acid
ECD: Ectodomain
EV71: Enterovirus 71
HPV: Human Papillomavirus
IFN: Interferon
IL-1: Interleukin 1
IRF3: Interferon Regulatory Factor 3
ISG: Interferon-stimulated Gene
LPS: Lipopolysaccharide
LRR: Leucine-rich Repeat
LRRCT: Leucine-rich Repeat Carboxyl-terminal
LRRNT: Leucine-rich Repeat Amino-terminal
LTA: Lipoteichoic Acid
MAPK: Mitogen Activated Protein Kinase
MyD88: Myeloid Differentiation Primary Response Protein 88
NF-κB: Nuclear Factor Kappa Light Chain Enhancer of Activated B
NK: Natural Killer Cell
NOD: Nucleotide-binding Oligomerization Domain
ODN: Oligodeoxynucleotides
PAMP: Pathogen-associated Molecular Patterns
poly(I:C) Acid: Polycytidylic Acid
PRR: Pattern Recognition Receptors
RNA: Ribonucleic Acid
SCARB2: Human Scavenger Receptor Class B Member 2
STAT1/2: Signal Transducer and Activator of Transcription 1/2
TICAM-1: Receptor Adaptor Molecule 1
TIR: Toll/Interleukin-1
TLR: Toll-like Receptor
TM: Transmembrane
TNF-α: Tumor Necrosis Factor Alpha
TRIF: TIR-domain-containing Adapter-inducing Interferon-β
IRAK4: Interleukin-1 Receptor-associated Kinase 4
XUNG ĐỘT LỢI ÍCH
Các tác giả cam kết không có xung đột lợi ích.
ĐÓNG GÓP CỦA TÁC GIẢ
Lê Thị Xuân Trang viết, tổng hợp và chỉnh sửa bản thảo.
Mai Quốc Gia, Đào Mỹ Linh tham gia viết, tổng hợp và chỉnh sửa bản thảo.
Nguyễn Thị Phương Thảo tham gia tổng hợp và chỉnh sửa bản thảo.
Trần Văn Hiếu lên ý tưởng, tham gia chỉnh sửa bản thảo và chấp nhận bản thảo.
Tất cả các tác giả đồng ý với bản thảo cuối cùng.
References
- Scapigliati G, Fausto AM, Picchietti S. Fish Lymphocytes: An Evolutionary Equivalent of Mammalian Innate-Like Lymphocytes? Front Immunol. 2018;9:971. . ;:. PubMed Google Scholar
- Du Pasquier L. Antibody diversity in lower vertebrates--why is it so restricted? Nature. 1982;296(5855):311-3. . ;:. PubMed Google Scholar
- Abram QH, Dixon B, Katzenback BA. Impacts of Low Temperature on the Teleost Immune System. Biology (Basel). 2017;6(4). . ;:. PubMed Google Scholar
- Li J, Barreda DR, Zhang YA, Boshra H, Gelman AE, Lapatra S, et al. B lymphocytes from early vertebrates have potent phagocytic and microbicidal abilities. Nat Immunol. 2006;7(10):1116-24. . ;:. PubMed Google Scholar
- Fan G, Chen J, Jin T, Shi C, Du X, Zhang H, et al. The Report of Marine Life Genomic Research. 2018. . ;:. Google Scholar
- Bassity E, Clark TG. Functional identification of dendritic cells in the teleost model, rainbow trout (Oncorhynchus mykiss). PLoS One. 2012;7(3):e33196. . ;:. PubMed Google Scholar
- Sahoo BR. Structure of fish Toll-like receptors (TLR) and NOD-like receptors (NLR). Int J Biol Macromol. 2020;161:1602-17. . ;:. PubMed Google Scholar
- Rosadini CV, Kagan JC. Early innate immune responses to bacterial LPS. Curr Opin Immunol. 2017;44:14-9. . ;:. PubMed Google Scholar
- Alkie TN, de Jong J, Jenik K, Klinger KM, DeWitte-Orr SJ. Enhancing innate antiviral immune responses in rainbow trout by double stranded RNA delivered with cationic phytoglycogen nanoparticles. Sci Rep. 2019;9(1):13619. . ;:. PubMed Google Scholar
- Wojciechowski M, Czapinska H, Bochtler M. CpG underrepresentation and the bacterial CpG-specific DNA methyltransferase M.MpeI. Proceedings of the National Academy of Sciences. 2013;110(1):105-10. . ;:. PubMed Google Scholar
- Mogensen TH. Pathogen recognition and inflammatory signaling in innate immune defenses. Clin Microbiol Rev. 2009;22(2):240-73, Table of Contents. . ;:. PubMed Google Scholar
- Chen SN, Zou PF, Nie P. Retinoic acid-inducible gene I (RIG-I)-like receptors (RLRs) in fish: current knowledge and future perspectives. Immunology. 2017;151(1):16-25. . ;:. PubMed Google Scholar
- Zhang L, Gao Z, Yu L, Zhang B, Wang J, Zhou J. Nucleotide-binding and oligomerization domain (NOD)-like receptors in teleost fish: Current knowledge and future perspectives. J Fish Dis. 2018;41(9):1317-30. . ;:. PubMed Google Scholar
- Petit J, Bailey EC, Wheeler RT, de Oliveira CAF, Forlenza M, Wiegertjes GF. Studies Into beta-Glucan Recognition in Fish Suggests a Key Role for the C-Type Lectin Pathway. Front Immunol. 2019;10:280. . ;:. PubMed Google Scholar
- Takeda K, Akira S. Toll-like receptors. Curr Protoc Immunol. 2015;109:14.2.1-.2.0. . ;:. PubMed Google Scholar
- Zhang J, Kong X, Zhou C, Li L, Nie G, Li X. Toll-like receptor recognition of bacteria in fish: ligand specificity and signal pathways. Fish Shellfish Immunol. 2014;41(2):380-8. . ;:. PubMed Google Scholar
- Oshiumi H, Tsujita T, Shida K, Matsumoto M, Ikeo K, Seya T. Prediction of the prototype of the human Toll-like receptor gene family from the pufferfish, Fugu rubripes, genome. Immunogenetics. 2003;54(11):791-800. . ;:. PubMed Google Scholar
- Rebl A, Siegl E, Kollner B, Fischer U, Seyfert HM. Characterization of twin toll-like receptors from rainbow trout (Oncorhynchus mykiss): evolutionary relationship and induced expression by Aeromonas salmonicida salmonicida. Dev Comp Immunol. 2007;31(5):499-510. . ;:. PubMed Google Scholar
- Xiao X, Qin Q, Chen X. Molecular characterization of a Toll-like receptor 22 homologue in large yellow croaker (Pseudosciaena crocea) and promoter activity analysis of its 5'-flanking sequence. Fish Shellfish Immunol. 2011;30(1):224-33. . ;:. PubMed Google Scholar
- Su J, Heng J, Huang T, Peng L, Yang C, Li Q. Identification, mRNA expression and genomic structure of TLR22 and its association with GCRV susceptibility/resistance in grass carp (Ctenopharyngodon idella). Dev Comp Immunol. 2012;36(2):450-62. . ;:. PubMed Google Scholar
- Lv J, Huang R, Li H, Luo D, Liao L, Zhu Z, et al. Cloning and characterization of the grass carp (Ctenopharyngodon idella) Toll-like receptor 22 gene, a fish-specific gene. Fish Shellfish Immunol. 2012;32(6):1022-31. . ;:. PubMed Google Scholar
- Ding X, Lu DQ, Hou QH, Li SS, Liu XC, Zhang Y, et al. Orange-spotted grouper (Epinephelus coioides) toll-like receptor 22: molecular characterization, expression pattern and pertinent signaling pathways. Fish Shellfish Immunol. 2012;33(3):494-503. . ;:. PubMed Google Scholar
- Panda RP, Chakrapani V, Patra SK, Saha JN, Jayasankar P, Kar B, et al. First evidence of comparative responses of Toll-like receptor 22 (TLR22) to relatively resistant and susceptible Indian farmed carps to Argulus siamensis infection. Dev Comp Immunol. 2014;47(1):25-35. . ;:. PubMed Google Scholar
- Munoz I, Sepulcre MP, Meseguer J, Mulero V. Toll-like receptor 22 of gilthead seabream, Sparus aurata: molecular cloning, expression profiles and post-transcriptional regulation. Dev Comp Immunol. 2014;44(1):173-9. . ;:. PubMed Google Scholar
- Samanta M, Swain B, Basu M, Mahapatra G, Sahoo BR, Paichha M, et al. Toll-like receptor 22 in Labeo rohita: molecular cloning, characterization, 3D modeling, and expression analysis following ligands stimulation and bacterial infection. Appl Biochem Biotechnol. 2014;174(1):309-27. . ;:. PubMed Google Scholar
- Matsuo A, Oshiumi H, Tsujita T, Mitani H, Kasai H, Yoshimizu M, et al. Teleost TLR22 recognizes RNA duplex to induce IFN and protect cells from birnaviruses. J Immunol. 2008;181(5):3474-85. . ;:. PubMed Google Scholar
- Wang RH, Li W, Fan YD, Liu QL, Zeng LB, Xiao TY. Tlr22 structure and expression characteristic of barbel chub, Squaliobarbus curriculus provides insights into antiviral immunity against infection with grass carp reovirus. Fish Shellfish Immunol. 2017;66:120-8. . ;:. PubMed Google Scholar
- Du X, Wu J, Li Y, Xia P, Li D, Yang X, et al. Multiple subtypes of TLR22 molecule from Schizothorax prenanti present the functional diversity in ligand recognition and signal activation. Fish Shellfish Immunol. 2019;93:986-96. . ;:. PubMed Google Scholar
- Botos I, Liu L, Wang Y, Segal DM, Davies DR. The toll-like receptor 3:dsRNA signaling complex. Biochim Biophys Acta. 2009;1789(9-10):667-74. . ;:. PubMed Google Scholar
- Sahoo BR, Dikhit MR, Bhoi GK, Maharana J, Lenka SK, Dubey PK, et al. Understanding the distinguishable structural and functional features in zebrafish TLR3 and TLR22, and their binding modes with fish dsRNA viruses: an exploratory structural model analysis. Amino Acids. 2015;47(2):381-400. . ;:. PubMed Google Scholar
- Matsushima N, Tanaka T, Enkhbayar P, Mikami T, Taga M, Yamada K, et al. Comparative sequence analysis of leucine-rich repeats (LRRs) within vertebrate toll-like receptors. BMC Genomics. 2007;8:124. . ;:. PubMed Google Scholar
- Ve T, Williams SJ, Kobe B. Structure and function of Toll/interleukin-1 receptor/resistance protein (TIR) domains. Apoptosis. 2015;20(2):250-61. . ;:. PubMed Google Scholar
- Nyman T, Stenmark P, Flodin S, Johansson I, Hammarstrom M, Nordlund P. The crystal structure of the human toll-like receptor 10 cytoplasmic domain reveals a putative signaling dimer. J Biol Chem. 2008;283(18):11861-5. . ;:. PubMed Google Scholar
- Behzadi P, Garcia-Perdomo HA, Karpinski TM. Toll-Like Receptors: General Molecular and Structural Biology. J Immunol Res. 2021;2021:9914854. . ;:. PubMed Google Scholar
- Qi Z, Xu Y, Wang X, Jiang J, Meng F, Zhang Q, et al. Structural analysis of toll-like receptor 18 from soiny mullet (Liza haematocheila): Giving insights on the ligand binding mechanism of fish specific TLRs. Fish Shellfish Immunol. 2020;107(Pt B):490-6. . ;:. PubMed Google Scholar
- Sundaram AY, Kiron V, Dopazo J, Fernandes JM. Diversification of the expanded teleost-specific toll-like receptor family in Atlantic cod, Gadus morhua. BMC Evol Biol. 2012;12:256. . ;:. PubMed Google Scholar
- Ji J, Liao Z, Rao Y, Li W, Yang C, Yuan G, et al. Thoroughly Remold the Localization and Signaling Pathway of TLR22. Front Immunol. 2019;10:3003. . ;:. PubMed Google Scholar
- Li H, Yang G, Ma F, Li T, Yang H, Rombout JH, et al. Molecular characterization of a fish-specific toll-like receptor 22 (TLR22) gene from common carp (Cyprinus carpio L.): Evolutionary relationship and induced expression upon immune stimulants. Fish Shellfish Immunol. 2017;63:74-86. . ;:. PubMed Google Scholar
- Paria A, Makesh M, Chaudhari A, Purushothaman CS, Rajendran KV. Toll-like receptor (TLR) 22, a non-mammalian TLR in Asian seabass, Lates calcarifer: Characterisation, ontogeny and inductive expression upon exposure with bacteria and ligands. Dev Comp Immunol. 2018;81:180-6. . ;:. PubMed Google Scholar
- Sahoo BR, Basu M, Swain B, Maharana J, Dikhit MR, Jayasankar P, et al. Structural insights of rohu TLR3, its binding site analysis with fish reovirus dsRNA, poly I:C and zebrafish TRIF. Int J Biol Macromol. 2012;51(4):531-43. . ;:. PubMed Google Scholar
- Chakrapani V, Rasal KD, Kumar S, Mohapatra SD, Sundaray JK, Jayasankar P, et al. In Silico Analysis of nsSNPs of Carp TLR22 Gene Affecting its Binding Ability with Poly I:C. Interdiscip Sci. 2018;10(4):641-52. . ;:. PubMed Google Scholar
- Sundaram AY, Consuegra S, Kiron V, Fernandes JM. Positive selection pressure within teleost Toll-like receptors tlr21 and tlr22 subfamilies and their response to temperature stress and microbial components in zebrafish. Mol Biol Rep. 2012;39(9):8965-75. . ;:. PubMed Google Scholar
- Wang Y, Liu L, Davies DR, Segal DM. Dimerization of Toll-like receptor 3 (TLR3) is required for ligand binding. J Biol Chem. 2010;285(47):36836-41. . ;:. PubMed Google Scholar
- Takada E, Okahira S, Sasai M, Funami K, Seya T, Matsumoto M. C-terminal LRRs of human Toll-like receptor 3 control receptor dimerization and signal transmission. Mol Immunol. 2007;44(15):3633-40. . ;:. PubMed Google Scholar
- Godfroy JI, III, Roostan M, Moroz YS, Korendovych IV, Yin H. Isolated Toll-like Receptor Transmembrane Domains Are Capable of Oligomerization. PLOS ONE. 2012;7(11):e48875. . ;:. PubMed Google Scholar
- Jin MS, Kim SE, Heo JY, Lee ME, Kim HM, Paik SG, et al. Crystal structure of the TLR1-TLR2 heterodimer induced by binding of a tri-acylated lipopeptide. Cell. 2007;130(6):1071-82. . ;:. PubMed Google Scholar
- Slack JL, Schooley K, Bonnert TP, Mitcham JL, Qwarnstrom EE, Sims JE, et al. Identification of two major sites in the type I interleukin-1 receptor cytoplasmic region responsible for coupling to pro-inflammatory signaling pathways. J Biol Chem. 2000;275(7):4670-8. . ;:. PubMed Google Scholar
- Zhang J, Kong X, Zhou C, Li L, Nie G, Li X. Toll-like receptor recognition of bacteria in fish: Ligand specificity and signal pathways. Fish & Shellfish Immunology. 2014;41(2):380-8. . ;:. PubMed Google Scholar
- Rauta PR, Samanta M, Dash HR, Nayak B, Das S. Toll-like receptors (TLRs) in aquatic animals: signaling pathways, expressions and immune responses. Immunol Lett. 2014;158(1-2):14-24. . ;:. PubMed Google Scholar
- De S, Karim F, Kiessu E, Cushing L, Lin LL, Ghandil P, et al. Mechanism of dysfunction of human variants of the IRAK4 kinase and a role for its kinase activity in interleukin-1 receptor signaling. J Biol Chem. 2018;293(39):15208-20. . ;:. PubMed Google Scholar
- Zhang J, Macartney T, Peggie M, Cohen P. Interleukin-1 and TRAF6-dependent activation of TAK1 in the absence of TAB2 and TAB3. Biochem J. 2017;474(13):2235-48. . ;:. PubMed Google Scholar
- Bhoj VG, Chen ZJ. Ubiquitylation in innate and adaptive immunity. Nature. 2009;458(7237):430-7. . ;:. PubMed Google Scholar
- Li X, Jiang S, Tapping RI. Toll-like receptor signaling in cell proliferation and survival. Cytokine. 2010;49(1):1-9. . ;:. PubMed Google Scholar
- Maruyama K, Kawagoe T, Kondo T, Akira S, Takeuchi O. TRAF family member-associated NF-κB activator (TANK) is a negative regulator of osteoclastogenesis and bone formation. J Biol Chem. 2012;287(34):29114-24. . ;:. PubMed Google Scholar
- Schulz KS, Mossman KL. Viral Evasion Strategies in Type I IFN Signaling - A Summary of Recent Developments. Front Immunol. 2016;7:498. . ;:. PubMed Google Scholar
- Chang M, Jin W, Sun SC. Peli1 facilitates TRIF-dependent Toll-like receptor signaling and proinflammatory cytokine production. Nat Immunol. 2009;10(10):1089-95. . ;:. PubMed Google Scholar
- Sullivan C, Postlethwait JH, Lage CR, Millard PJ, Kim CH. Evidence for Evolving Toll-IL-1 Receptor-Containing Adaptor Molecule Function in Vertebrates. The Journal of Immunology. 2007;178(7):4517-27. . ;:. PubMed Google Scholar
- Hirono I, Takami M, Miyata M, Miyazaki T, Han HJ, Takano T, et al. Characterization of gene structure and expression of two toll-like receptors from Japanese flounder, Paralichthys olivaceus. Immunogenetics. 2004;56(1):38-46. . ;:. PubMed Google Scholar
- Zou J, Secombes CJ. Teleost fish interferons and their role in immunity. Dev Comp Immunol. 2011;35(12):1376-87. . ;:. PubMed Google Scholar
- Verrier ER, Langevin C, Benmansour A, Boudinot P. Early antiviral response and virus-induced genes in fish. Dev Comp Immunol. 2011;35(12):1204-14. . ;:. PubMed Google Scholar
- Haller O, Staeheli P, Kochs G. Interferon-induced Mx proteins in antiviral host defense. Biochimie. 2007;89(6-7):812-8. . ;:. PubMed Google Scholar
- Larsen R, Røkenes TP, Robertsen B. Inhibition of infectious pancreatic necrosis virus replication by atlantic salmon Mx1 protein. J Virol. 2004;78(15):7938-44. . ;:. PubMed Google Scholar
- Caipang CM, Hirono I, Aoki T. In vitro inhibition of fish rhabdoviruses by Japanese flounder, Paralichthys olivaceus Mx. Virology. 2003;317(2):373-82. . ;:. PubMed Google Scholar
- Langevin C, van der Aa LM, Houel A, Torhy C, Briolat V, Lunazzi A, et al. Zebrafish ISG15 exerts a strong antiviral activity against RNA and DNA viruses and regulates the interferon response. J Virol. 2013;87(18):10025-36. . ;:. PubMed Google Scholar
- Huang X, Huang Y, Cai J, Wei S, Ouyang Z, Qin Q. Molecular cloning, expression and functional analysis of ISG15 in orange-spotted grouper, Epinephelus coioides. Fish Shellfish Immunol. 2013;34(5):1094-102. . ;:. PubMed Google Scholar
- Zhang YB, Jiang J, Chen YD, Zhu R, Shi Y, Zhang QY, et al. The innate immune response to grass carp hemorrhagic virus (GCHV) in cultured Carassius auratus blastulae (CAB) cells. Dev Comp Immunol. 2007;31(3):232-43. . ;:. PubMed Google Scholar
- Suprunenko T, Hofer MJ. The emerging role of interferon regulatory factor 9 in the antiviral host response and beyond. Cytokine Growth Factor Rev. 2016;29:35-43. . ;:. PubMed Google Scholar
- Horiuchi T, Mitoma H, Harashima S, Tsukamoto H, Shimoda T. Transmembrane TNF-alpha: structure, function and interaction with anti-TNF agents. Rheumatology (Oxford). 2010;49(7):1215-28. . ;:. PubMed Google Scholar
- Hong S, Peddie S, Campos-Perez JJ, Zou J, Secombes CJ. The effect of intraperitoneally administered recombinant IL-1beta on immune parameters and resistance to Aeromonas salmonicida in the rainbow trout (Oncorhynchus mykiss). Dev Comp Immunol. 2003;27(9):801-12. . ;:. PubMed Google Scholar
- Martin SA, Zou J, Houlihan DF, Secombes CJ. Directional responses following recombinant cytokine stimulation of rainbow trout (Oncorhynchus mykiss) RTS-11 macrophage cells as revealed by transcriptome profiling. BMC Genomics. 2007;8:150. . ;:. PubMed Google Scholar
- Schroder K, Tschopp J. The Inflammasomes. Cell. 2010;140(6):821-32. . ;:. PubMed Google Scholar
- Reis MI, do Vale A, Pereira PJ, Azevedo JE, Dos Santos NM. Caspase-1 and IL-1beta processing in a teleost fish. PLoS One. 2012;7(11):e50450. . ;:. PubMed Google Scholar
- Vollmer J, Weeratna RD, Jurk M, Samulowitz U, McCluskie MJ, Payette P, et al. Oligodeoxynucleotides lacking CpG dinucleotides mediate Toll-like receptor 9 dependent T helper type 2 biased immune stimulation. Immunology. 2004;113(2):212-23. . ;:. PubMed Google Scholar
- Jorgensen JB, Johansen LH, Steiro K, Johansen A. CpG DNA induces protective antiviral immune responses in Atlantic salmon (Salmo salar L.). J Virol. 2003;77(21):11471-9. . ;:. PubMed Google Scholar
- Lee CH, Jeong HD, Chung JK, Lee HH, Kim KH. CpG motif in synthetic ODN primes respiratory burst of olive flounder Paralichthys olivaceus phagocytes and enhances protection against Edwardsiella tarda. Dis Aquat Organ. 2003;56(1):43-8. . ;:. PubMed Google Scholar
- Ioannou XP, Griebel P, Hecker R, Babiuk LA, van Drunen Littel-van den Hurk S. The immunogenicity and protective efficacy of bovine herpesvirus 1 glycoprotein D plus Emulsigen are increased by formulation with CpG oligodeoxynucleotides. J Virol. 2002;76(18):9002-10. . ;:. PubMed Google Scholar
- Harandi AM, Eriksson K, Holmgren J. A protective role of locally administered immunostimulatory CpG oligodeoxynucleotide in a mouse model of genital herpes infection. J Virol. 2003;77(2):953-62. . ;:. PubMed Google Scholar
- Jensen I, Albuquerque A, Sommer AI, Robertsen B. Effect of poly I:C on the expression of Mx proteins and resistance against infection by infectious salmon anaemia virus in Atlantic salmon. Fish Shellfish Immunol. 2002;13(4):311-26. . ;:. PubMed Google Scholar
- Arnemo M, Kavaliauskis A, Gjoen T. Effects of TLR agonists and viral infection on cytokine and TLR expression in Atlantic salmon (Salmo salar). Dev Comp Immunol. 2014;46(2):139-45. . ;:. PubMed Google Scholar
- Strayer DR, Carter WA, Brodsky I, Cheney P, Peterson D, Salvato P, et al. A controlled clinical trial with a specifically configured RNA drug, poly(I).poly(C12U), in chronic fatigue syndrome. Clin Infect Dis. 1994;18 Suppl 1:S88-95. . ;:. PubMed Google Scholar
- Robinson RA, DeVita VT, Levy HB, Baron S, Hubbard SP, Levine AS. A phase I-II trial of multiple-dose polyriboinosic-polyribocytidylic acid in patieonts with leukemia or solid tumors. J Natl Cancer Inst. 1976;57(3):599-602. . ;:. PubMed Google Scholar
- Thompson KA, Strayer DR, Salvato PD, Thompson CE, Klimas N, Molavi A, et al. Results of a double-blind placebo-controlled study of the double-stranded RNA drug polyI:polyC12U in the treatment of HIV infection. Eur J Clin Microbiol Infect Dis. 1996;15(7):580-7. . ;:. PubMed Google Scholar
- Schön MP, Schön M. The small-molecule immune response modifier imiquimod--its mode of action and clinical use in the treatment of skin cancer. Expert Opin Ther Targets. 2006;10(1):69-76. . ;:. PubMed Google Scholar
- Vidal D. Topical imiquimod: mechanism of action and clinical applications. Mini Rev Med Chem. 2006;6(5):499-503. . ;:. PubMed Google Scholar
- Richards KH, Wasson CW, Watherston O, Doble R, Eric Blair G, Wittmann M, et al. The human papillomavirus (HPV) E7 protein antagonises an Imiquimod-induced inflammatory pathway in primary human keratinocytes. Scientific Reports. 2015;5(1):12922. . ;:. PubMed Google Scholar
- Tomai MA, Miller RL, Lipson KE, Kieper WC, Zarraga IE, Vasilakos JP. Resiquimod and other immune response modifiers as vaccine adjuvants. Expert Rev Vaccines. 2007;6(5):835-47. . ;:. PubMed Google Scholar
- Pockros PJ, Guyader D, Patton H, Tong MJ, Wright T, McHutchison JG, et al. Oral resiquimod in chronic HCV infection: safety and efficacy in 2 placebo-controlled, double-blind phase IIa studies. J Hepatol. 2007;47(2):174-82. . ;:. PubMed Google Scholar
- Bohannon JK, Hernandez A, Enkhbaatar P, Adams WL, Sherwood ER. The immunobiology of toll-like receptor 4 agonists: from endotoxin tolerance to immunoadjuvants. Shock. 2013;40(6):451-62. . ;:. PubMed Google Scholar
- Boghdadi G, Hammad N, Amer A, Sammour S, Sorour S. R848, a Toll-like receptors 7 and 8 agonist, a potential therapy for allergic rhinitis patients. Inflamm Allergy Drug Targets. 2014;13(2):144-9. . ;:. PubMed Google Scholar
- Barjesteh N, Shojadoost B, Brisbin JT, Emam M, Hodgins DC, Nagy É, et al. Reduction of avian influenza virus shedding by administration of Toll-like receptor ligands to chickens. Vaccine. 2015;33(38):4843-9. . ;:. PubMed Google Scholar
- Nyholm SV, Graf J. Knowing your friends: invertebrate innate immunity fosters beneficial bacterial symbioses. Nat Rev Microbiol. 2012;10(12):815-27. . ;:. PubMed Google Scholar
- Wang X-W, Vasta GR, Wang J-X. The functional relevance of shrimp C-type lectins in host-pathogen interactions. Developmental & Comparative Immunology. 2020;109:103708. . ;:. PubMed Google Scholar
- Phuong-Thao Thi Nguyen L-VHN, Thang Tan Nguyen, Kim-Loan Thi Nguyen, Tran-Van H. Cloning, Expression and Purification of Vibrio parahaemolyticus L-type Lectin from White Leg Shrimp Litopenaeus vannamei for Bacterial Agglutinating. SSR Inst Int J Life Sci. 2020;06(03). . ;:. Google Scholar
- Yamayoshi S, Fujii K, Koike S. Scavenger receptor b2 as a receptor for hand, foot, and mouth disease and severe neurological diseases. Front Microbiol. 2012;3:32. . ;:. PubMed Google Scholar
- Vo-Nguyen H-V, Nguyen T-T, Vu H-TT, Nguyen T-TT, Hoang Q-C, Tran TL, et al. Recombinant Human SCARB2 Expressed in Escherichia coli and its Potential in Enterovirus 71 Blockage. Iranian Journal of Science and Technology, Transactions A: Science. 2021;45(2):455-61. . ;:. PubMed Google Scholar
- Triet TH, Tinh BTT, Hau LV, Huong TV, Binh NQ. Development and potential use of an Edwardsiella ictaluri wzz mutant as a live attenuated vaccine against enteric septicemia in Pangasius hypophthalmus (Tra catfish). Fish Shellfish Immunol. 2019;87:87-95. . ;:. PubMed Google Scholar
- Wise DJ, Greenway TE, Byars TS, Griffin MJ, Khoo LH. Oral Vaccination of Channel Catfish against Enteric Septicemia of Catfish Using a Live Attenuated Edwardsiella ictaluri Isolate. J Aquat Anim Health. 2015;27(2):135-43. . ;:. PubMed Google Scholar
- Dhar AK, Manna SK, Thomas Allnutt FC. Viral vaccines for farmed finfish. Virusdisease. 2014;25(1):1-17. . ;:. PubMed Google Scholar

 Open Access
Open Access 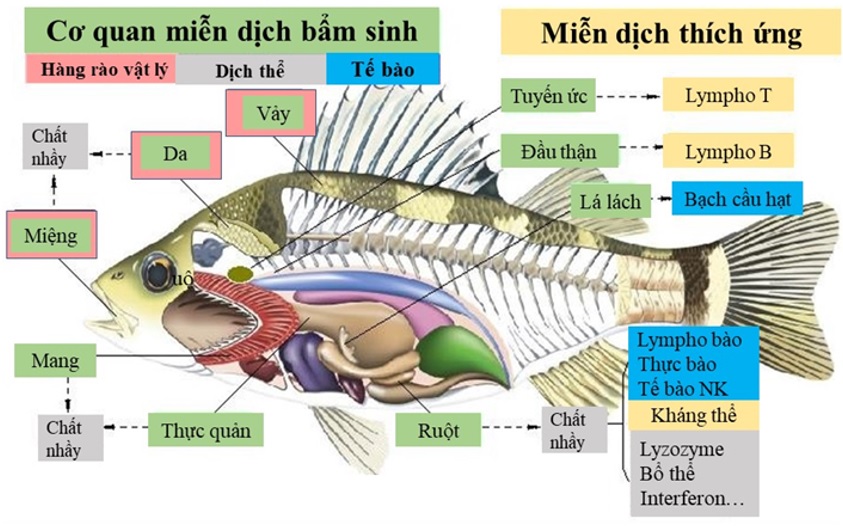 5" width="300" height="200">
5" width="300" height="200">
 7" width="300" height="200">
7" width="300" height="200">
 7" width="300" height="200">
7" width="300" height="200">
 30" width="300" height="200">
30" width="300" height="200">
 21" width="300" height="200">
21" width="300" height="200">

 48" width="300" height="200">
48" width="300" height="200">
 67" width="300" height="200">
67" width="300" height="200">









