Abstract
SARS-CoV-2 can cause severe acute respiratory illness and multi-organ injury. Angiotensin-converting enzyme 2 (ACE2) is an important enzyme of the renin-angiotensin system (RAS), which is the main receptor for entry of SARS-CoV-2 into host cells. Both cell surface ACE2 and soluble ACE2 (sACE2) can interact with the receptor binding domain (RBD) in SARS-CoV-2 S protein. After binding to cell surface ACE2, SARS-CoV-2 enters host cells by direct fusion of the viral with host cell membranes with the support of host’s TMPRSS2 (transmembrane serine protease 2) and furin. In contrast, sACE2-bound SARS-CoV-2 enters host cells through AT1 (Angiotensin type 1 receptor) and AVPR1B (arginine vasopressin receptor 1B). The entery process strongly down regulates membrane-bound ACE2, promoting an activation of the canonical pathway of RAS (ACE-Ang II-AT1 receptor axis). Consequently, this promotes an intense activity of NF-kB (nuclear factor kappa B), which in turn increases the transcription of IL-6, and triggers the cytokine storm. Moreover, the decreasing of ACE2 function in lung leed to the activation of DABK/BKB1R axis signaling, contributing to the pathogenesis of acute lung inflammation. This review summarizes information about the role of ACE2 in SARS-CoV-2 infection and Covid-19, also the research directions for prevention and treatment of Covid-19 which based on ACE2.
GIỚI THIỆU
Covid-19 (Coronavirus disease 2019) là bệnh suy hô hấp cấp do SARS-CoV-2, phân biệt với bệnh suy hô hấp cấp SARS vào năm 2002 do SARS-CoV. Tâm dịch đầu tiên xuất hiện tại thành phố Vũ Hán, tỉnh Hồ Bắc, Trung Quốc. Tiếp theo đó là hàng loạt ổ dịch bắt nguồn từ các sự kiện tập trung đông người đã khiến tốc độ lây lan SARS-CoV-2 tăng nhanh và dịch bệnh nhanh chóng xuất hiện ở nhiều quốc gia. Vào ngày 11/3/2020, WHO tuyên bố Covid-19 là đại dịch toàn cầu.
SARS-CoV-2 có sự tương đồng bộ gen đến 96% với các chủng coronavirus được tìm thấy ở dơi và 79,5% với SARS-CoV 1 , 2 . So với hai đợt dịch gây ra bởi các chủng coronavirus trước đây thì SARS-CoV-2 xuất hiện vào tháng 12/2019 đã nhanh chóng gây ra đại dịch toàn cầu. Coronavirus gây hội chứng hô hấp cấp SARS (SARS-CoV) lần đầu xuất hiện năm 2002, sau đó bùng phát và chấm dứt vào tháng 6 năm 2003. SARS-CoV gây tỷ lệ tử vong là 9,7% với 8096 trường hợp nhiễm và 774 trường hợp tử vong 3 . Trong khi đó, coronavirus gây hội chứng hô hấp Trung Đông (MERS-CoV) xuất hiện vào năm 2012 có tỷ lệ tử vong đến 34,4% với 2578 trường hợp nhiễm và 888 trường hợp tử vong ở 27 quốc gia nhưng không phải là mối đe dọa gây ra đại dịch 4 .
SARS-CoV-2 có khả năng gây tử vong ít hơn nhưng khả năng lây lan cao hơn nhiều so với MERS-CoV hoặc SARS-CoV. Tính đến ngày 21/02/2022, hơn 2 năm sau đợt dịch đầu tiên, trên thế giới đã có 425.084.678 ca nhiễm số với 5.906.564 ca tử vong chiếm tỷ lệ 1,39%, riêng tại Việt Nam là 2.787.493 ca nhiễm với 39.501 ca tử vong chiếm tỷ lệ 1,41% 5 .
Do phổ lâm sàng rộng và khả năng lây lan cao, việc loại trừ SARS-CoV-2, như đã được thực hiện với SARS-CoV vào năm 2003, dường như không phải là mục tiêu khả thi. Hiện tại việc bao phủ vaccine ngừa Covid-19 vẫn đang được tiến hành rộng khắp trên toàn cầu nhằm nhanh chóng đạt miễn dịch cộng đồng. Song song đó, việc nghiên cứu các phương pháp điều trị, dự phòng ngăn chặn sự lây lan của SARS-CoV-2 trong tình hình hiện nay vẫn đang được khẩn trương thực hiện.
Nhiều nghiên cứu được tiến hành để hướng đến việc điều trị nhắm mục tiêu chủ yếu dựa trên cách thức xâm nhập của SARS-CoV-2 vào cơ thể người. Các thụ thể giúp cho quá trình xâm nhập của SARS-CoV-2 đã được báo cáo gồm có ACE2 (angiotensin-converting enzyme 2), GRP78 (một protein sốc nhiệt chaperone), và CD147 (một glycoprotein xuyên màng) 6 , 7 , 8 . Trong đó ACE2, men chuyển angiotensin 2, là ứng viên sáng giá cho các giải pháp tiềm năng điều trị Covid-19 và ngăn chặn sự nhiễm SARS-CoV-2. ACE2 đóng vai trò là thụ thể chính của SARS-CoV-2 phối hợp với các protein cụ thể khác chi phối quá trình xâm nhập vào bên trong tế bào người 6 , 9 , 10 , 11 . Một khi tương tác giữa SARS-CoV-2 và ACE2 giảm đi sẽ giảm số lượng virus xâm nhiễm và nhân lên bên trong tế bào. Trong bài báo này, chúng tôi sẽ tổng hợp vai trò của ACE2 trong quá trình xâm nhiễm của SARS-CoV-2 vào tế bào và gây bệnh Covid-19. Từ đây giúp các nhà khoa học định hướng rõ hơn cho các nghiên cứu điều trị, dự phòng liên quan đến ACE2.
MỐI QUAN HỆ GIỮA ACE2 VÀ COVID-19
Quá trình xâm nhiễm và gây bệnh của SARS-CoV-2 tương tự với SARS-CoV 12 . Quá trình này khởi nguồn bằng cách gắn vùng gắn thụ thể (receptor binding domain, RBD) của protein S vào thụ thể ACE2 trên bề mặt tế bào người. Một vài đột biến trong vùng RBD của protein S đã làm tăng đáng kể khả năng liên kết ái lực của SARS-CoV-2 với ACE2, cao hơn 4 lần, thậm chí từ 10 đến 20 lần so với liên kết của SARS-CoV với ACE2 11 , 12 , 13 .
ACE2 là chất tương đồng của ACE (angiotensin-converting enzyme). Trong điều kiện sinh lý bình thường, ACE2 đóng vai trò quan trọng chống lại tác động tiêu cực của hệ thống renin-angiotensin (renin-angiotensin system, RAS) - hệ thống duy trì huyết áp cũng như cân bằng nội mô, chất điện giải, và dịch. Trong đó, angiotensin II (Ang-II) là peptide tiêu biểu nhất của RAS, góp phần vào sự tiến triển của các bệnh tim mạch (tăng huyết áp, nhồi máu cơ tim, suy tim). Cơ chế hoạt động của hệ thống này được tóm tắt như sau: renin phân cắt cơ chất angiotensinogen tạo thành decapeptide angiotensin I (Ang-I), sau đó ACE loại bỏ acid amin ở đầu cuối carboxyl của Ang-I tạo ra angiotensin II (Ang-II). Sự tương tác của Ang-II với các thụ thể AT1 (angiotensin type 1) gây tăng huyết áp do co mạch, tái hấp thu natri của thận, tăng sinh tế bào, phản ứng viêm, đông máu. Ngược lại, khi Ang-II liên kết với thụ thể AT2 (angiotensin type 2) chống lại các tác động nói trên của AT1 ( Figure 1 ) 14 . Đối trọng lại với tác động của ACE, ACE2 loại bỏ phenylalanine đầu tận cùng carboxyl trong Ang-II để tạo thành heptapeptide angiotensin-(1-7). Angiotensin-(1-7) liên kết với thụ thể MAS (còn gọi MAS1 oncogene, là một thụ thể gắn với protein G) có tác dụng giãn mạch, kháng viêm và chống oxi hóa, chống đông máu 15 , 16 . ACE2 cũng thủy phân Ang-I tạo thành angiotensin-(1-9) trước khi tạo thành angiotensin-(1-7) bởi ACE. Tuy nhiên, Ang-II là cơ chất được ưa thích của ACE2, có ái lực gấp 400 lần Ang-I 17 , 18 . Tại biểu mô và cơ trơn phế quản, angiotensin-(1-7) tương tác với thụ thể gắn ty thể và khởi sự chuỗi phản ứng nội bào ức chế protein kinase kích hoạt p38 (p38 mitogen-activated protein kinase) và các con đường của NF-kB (Nuclear factor kappa B, một phức hợp protein kiểm soát quá trình biểu hiện gene mã hóa của các cytokine, chemokine). Kết quả của quá trình này làm giảm mức độ biểu hiện các cytokine tiền viêm (như IL-6, TNF-a, và IL-8) và các yếu tố gây thoát mạch bạch cầu như ICAM-1 (intercellular adhesion molecule-1) và VCAM-1 (vascular cell adhesion molecule-1) 19 .
Một chức năng khác của ACE2 là phân cắt đầu cuối của des-Arg9-bradykinin (DABK), một yếu tố gây viêm phổi 20 . DABK là một thành phần của hệ thống kinin-kallikrein, hoạt động thông qua thụ thể bradykinin B1 (BKB1R) và thụ thể bradykinin B2 (BKB2R). Trong đó đáng lưu ý là sự kích hoạt của trục DABK/BKB1R sẽ phóng thích các chemokine tiền viêm như CXCL5 (C-X-C motif chemokine 5), MIP2 (macrophage inflammatory protein-2), KC (C-X-C motif chemokine 1), và TNF-α từ biểu mô đường hô hấp, tăng thâm nhiễm bạch cầu trung tính, gây viêm và tổn thương phổi quá mức. Do đó, giảm hoạt động ACE2 ở phổi góp phần vào cơ chế bệnh sinh của viêm phổi, do thúc đẩy tín hiệu qua trung gian trục DABK / BKB1R 20 , 21 . Nghiên cứu của Yumiko Imai và cộng sự (2005) đã chứng minh vai trò bảo vệ khỏi tổn thương phổi cấp nghiêm trọng phổi của ACE2 và thụ thể AT2 22 .
ACE2 được biểu hiện hầu hết ở các cơ quan người với các mức độ khác nhau 10 . ACE2 chủ yếu biểu hiện trên tế bào biểu mô phế nang loại II, nhưng biểu hiện yếu trên bề mặt tế bào biểu mô ở niêm mạc miệng, mũi và vòm họng, cho thấy phổi là mục tiêu chính của SARS-CoV-2 10 , 23 . Ngoài ra, ACE2 được biểu hiện nhiều ở tế bào cơ tim, tế bào ống lượn gần của thận và tế bào biểu mô bàng quang, tế bào biểu mô ruột của ruột non, đặc biệt là hồi tràng 23 . Trong khi tại phổi bình thường hơn 80% ACE2 phân bố ở tế bào phế nang loại II, phân tích mô phổi xơ hoá ở bệnh nhân Covid-19 cho thấy ACE2 biểu hiện chủ yếu ở tế bào động mạch. Điểm đến đầu tiên của dòng tuần hoàn từ phổi là tim lý giải cho tỉ lệ tổn thương tim cao ở những ca bệnh nặng và theo dòng tuần hoàn máu là bước quan trọng để SARS-CoV-2 lây truyền các cơ quan khác. Do đó, ngoài tổn thương phổi, SARS-CoV-2 có thể gây tổn thương cho nhiều cơ quan như tim, thận, gan, cơ xương, hệ thần kinh trung ương, tuyến thượng thận, và tuyến giáp bởi sự mất cân bằng trong hệ RAS 24 . Khi xâm nhiễm, một mặt protein S của SARS-CoV-2 liên kết với ACE2 bề mặt tế bào chủ và dung hợp màng sau đó cùng với ACE2, làm giảm biểu hiện ACE2 bề mặt. Mặt khác, sự nhập bào này càng làm tăng hoạt tính phân cắt ACE2 bề mặt của ADAM17 (ADAM metallopeptidase domain 17), và gây phóng thích tiền chất liên kết màng của các cytokine tiền viêm vào máu. Chính tác động kép của quá trình xâm nhiễm dẫn đến giảm biểu hiện trầm trọng ACE2 bề mặt tế bào, nơi ACE2 đóng vai trò bảo vệ. Kết quả của quá trình giảm biểu hiện là giảm phân cắt Ang-II và giảm lượng angiotensin-(1-7) tạo ra. Điều này kích hoạt con đường RAS kinh điển (trục ACE-AngII-AT1) vốn đã không còn sự đối trọng với con đường RAS không kinh điển (trục ACE2- angiotensin-(1-7)-MAS), kéo theo sự hoạt hóa qua trung gian glycoprotein 130 của chất dẫn truyền tín hiệu (glycoprotein 130-mediated activation of signal transducer) và chất kích hoạt phiên mã 3 (activator of transcription 3). Chuỗi tín hiệu này thúc đẩy hoạt động cường độ cao của NF-kB, do đó tăng phiên mã IL 6, và gây ra cơn bão cytokine 25 .
Figure 1 . Sự xâm nhiễm SARS-CoV-2 liên quan đến thụ thể ACE2 ảnh hưởng tới hoạt động của hệ RAS 14
Figure 2 . Cấu trúc các thành phần SARS-CoV-2 (A) và các protein được mã hoá trong bộ gen của SARS-CoV-2 (B) 17
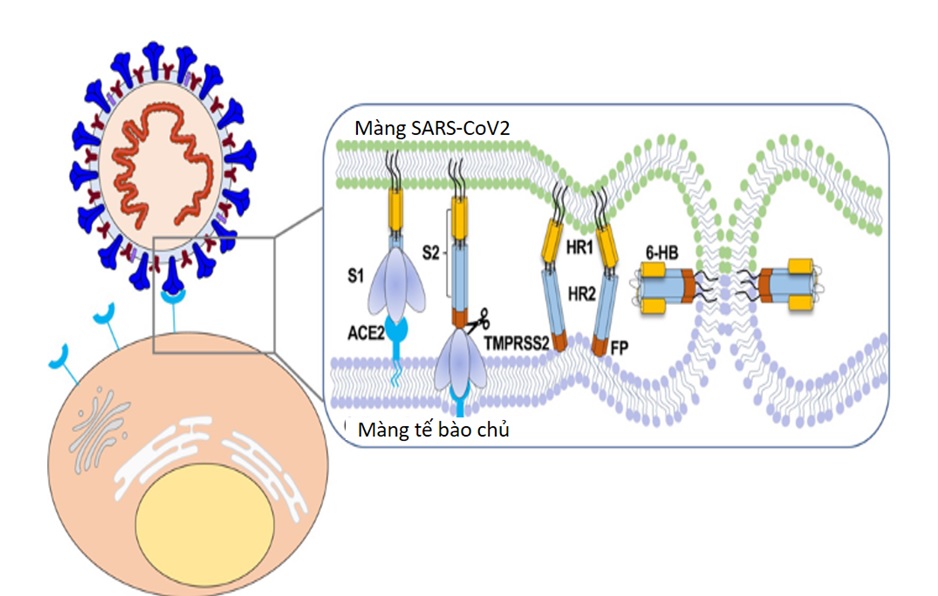
Figure 3 . Quá trình xâm nhiễm của SARS-CoV-2 thông qua ACE2 trên bề mặt tế bào 17
Khi nhiễm SARS-CoV-2, mức độ Ang-II trong tuần hoàn tăng lên tỷ lệ thuận với tải lượng virus kèm với tổn thương phổi cho thấy mối liên hệ trực tiếp giữa điều hòa giảm ACE2 ở mô với sự mất cân bằng sinh lý của RAS và sự tổn thương cơ quan nghiêm trọng ở bệnh nhân Covid-19 18 , 26 .
Đặc điểm cấu trúc của SARS-CoV-2 giúp cho quá trình xâm nhiễm
SARS-CoV-2 thuộc họ Coronaviridae , được cấu tạo từ bốn protein cấu trúc chính. Lõi nucleocapsid là sợi RNA đơn (+) với kích thước khoảng 29,9 kb được bao bọc bởi lớp áo nucleoprotein (N). Ngoài cùng là lớp vỏ cấu tạo từ lớp đôi phospholipid với các protein màng (M), protein đóng gói (E), và các protein S (S) đính trên màng 27 . Các protein N, E, M giúp tạo điều kiện cho quá trình hình thành các bản sao của virus trong tế bào 27 , 28 , 29 . Các protein S còn gọi là protein gai, nhô lên bề mặt lớp vỏ virus, đóng vai trò là kháng nguyên của SARS-CoV-2 và là mục tiêu phát triển các vaccine chống lại SARS-CoV-2 30 , 31 . Xung quanh các protein S có các phân tử glycoprotein tương tự như các phân tử đường gắn trên màng tế bào người, chính điều này khiến hệ miễn dịch khó phát hiện SARS-CoV-2 khi xâm nhập vào cơ thể 32 . Cấu trúc của protein S gồm 2 tiểu phần S1 và S2. Tiều phần S1 chứa peptide tín hiệu (SP), domain N-terminal (NTD), domain gắn thụ thể (RDB), subdomain 1 (SD1) và subdomain 2 (SD2). Tiểu phần S2 giúp cho quá trình dung hợp màng chứa các thành phần gồm peptide dung hợp (FP), cấu trúc lặp heptad 1 (HR1), cấu trúc lặp heptad 2 (HR2), phần kỵ nước của protein chuyển màng (TM) 28 ( Figure 2 ).
Mặc dù SARS-CoV-2 có sự tương đồng bộ gen đến 79,5 % với SARS-CoV nhưng khác biệt chủ yếu nằm ở khung đọc mở ORF1a và trình tự mã hoá protein S 1 . Trình tự RBD của protein S phần lớn được bảo tồn nhưng nhiều vị trí quan trọng liên quan đến tương tác ACE2 bị thay đổi 12 . Tuy nhiên, điều này không ảnh hưởng nhiều đến cấu trúc 3D của vùng RBD do đó cơ chế tương tác với ACE2 của SARS-CoV-2 cũng giống như SARS-CoV 12 .
Quá trình xâm nhiễm của SARS-CoV-2 thông qua ACE2
Tương tác phân tử giữa ACE2 và protein S của SARS-CoV-2
ACE2 tồn tại ở dạng trên bề mặt tế bào và dạng hòa tan trong máu. Trên bề mặt tế bào, cấu trúc ACE2 gồm 805 acid amin, chứa phần cấu trúc xuyên màng và phần ngoại bào đính vào màng tế bào chất (ectodomain). ACE2 dạng hòa tan chỉ có 740 acid amin được tạo thành do enzym ADAM17 cắt phần đính màng của ACE2. Trên phân tử ACE2, cấu trúc nhận diện cho RBD protein S của SARS-CoV-2 nằm ở phần ngoại màng có 282 acid amin nên cả dạng ACE2 bề mặt tế bào và dạng hòa tan đều có thể nhận diện SARS-CoV-2. Tuy nhiên, lượng ACE2 hòa tan rất thấp, không thể phát hiện được trong huyết thanh của những người khỏe mạnh 33 . Lượng ACE2 hòa tan tăng lên ở huyết thanh người bệnh tim mạch và tiểu đường do nồng độ Ang-II tăng cao 33 . Ở bệnh nhân Covid-19, mức độ biểu hiện của ACE2 trên tế bào giảm trong khi nồng độ ACE2 hòa tan tăng 34 . Từ đó cho thấy vai trò tiềm năng của việc đo ACE2 trong Covid-19 để dự đoán kết quả bệnh. Ngoài ra, mức ACE2 có thể cung cấp mối liên hệ giữa bệnh Covid-19 nghiêm trọng và các yếu tố nguy cơ khác 9 .
ACE2 liên kết với RBD của protein S (SARS-CoV-2) 12 , 13 . Phân tích cấu trúc bằng kính hiển vi X-quang và kính hiển vi điện tử đông lạnh (cryo-EM) cho thấy một phân tử RBD liên kết với một phân tử ACE2 13 . RBD có thể biểu hiện ở hai trạng thái tương ứng với chức năng mở (up-conformation) và đóng (down-conformation) thông qua chuyển động giống như cái bản lề 35 . Ở trạng thái “đóng”, tương tác của nó với ACE2 bị cản trở bởi cấu hình không gian. Việc chuyển đổi vị trí từ cấu trúc “đóng” sang “mở” của RBD bộc lộ vị trí liên kết thụ thể, do đó tạo điều kiện thuận lợi cho tương tác với ACE2. Hơn 16 gốc acid amin trong RBD ở trạng thái “mở” tương tác với 21 gốc acid amin của thụ thể ACE2 dựa trên các tương tác ái nước, bao gồm cầu nối muối (salt bridges) và liên kết hydro 11 .
Sau khi liên kết với ACE2, SARS-CoV-2 đi vào tế bào bằng cách dung hợp trực tiếp lớp vỏ phospholipide của virus với màng tế bào chủ 17 , hoặc dung hợp với màng của nội bào sau khi vào tế bào chủ 17 , 36 . Có 3 loại protease tham gia vào quá trình dung nạp và xâm nhập vào tế bào chủ là protein convertase (furin), protease bề mặt tế bào (TMPRSS2), và protease túi nhập bào (cathepsin) 37 , 38 , 39 .
Xâm nhiễm bằng cách thức dung hợp trực tiếp thông qua ACE2 trên bề mặt tế bào
Ở trạng thái tự nhiên, protein S tồn tại dưới dạng không hoạt động, khi đó tiểu phần S1 liên kết với S2 nhờ bốn amino acid (682-Arg-Arg-Ala-Arg-685) 12 . Liên kết này giúp protein S có khả năng bị phân cắt và khả năng lây nhiễm của SARS-CoV-2 cao hơn so với SARS-CoV 40 . Khi xâm nhiễm tế bào chủ, protein S gắn với thụ thể ACE2 trên bề mặt tế bào và được kích hoạt, phân cắt thành các tiểu đơn vị S1 và S2 bởi các protease của tế bào đích bao gồm furin và TMPRSS2. Furin cắt vị trí liên kết giữa S1 và S2 tạo thành tiểu đơn vị S1 ra khỏi S2. Sau đó, TMPRSS2 cắt bỏ hai acid amin tại vị trí S2’ để lộ phần peptide dung hợp (FP) của SARS-CoV-2 40 , 37 . Tiếp theo, tiểu đơn vị S2 biến đổi cấu hình do phần HR1 và HR2 tương tác tạo thành cấu trúc hình “quả tạ” ổn định, gồm sáu chuỗi xoắn song song đối nhau (6-HB, 6 helix bundle) dẫn đến sự dung hợp màng giữa virus và tế bào vật chủ 40 ( Figure 3 ). Ngoài ra, ACE2 hiện diện ở tế bào thận, phổi, và đường tiêu hóa cùng với TMPRSS2 làm tăng khả năng lây nhiễm ở các tế bào này.
Xâm nhiễm bằng cách thức dung hợp túi nội bào thông qua ACE2 hoà tan (sACE2)
Hầu hết các nghiên cứu bệnh học liên quan SARS-CoV-2 chỉ tập trung vào ACE2 bề mặt tế bào, tác động của ACE2 hòa tan trong việc xâm nhiễm chưa được biết đến rộng rãi. Như đã đề cập ở trên, protein S tương tác với ACE2 bề mặt làm giảm mức độ biểu hiện ACE2 bề mặt. Thêm vào đó, cách thức nhập bào này còn làm tăng hoạt tính ADAM17, một enzyme phân cắt ACE2 bề mặt phóng thích sACE2 vào máu càng làm giảm biểu hiện ACE2 bề mặt tế bào, dẫn tới sự giảm sút trầm trọng tác động bảo vệ của RAS ở mô. Sự phân cắt ACE2 trên bề mặt tế bào có thể điều chỉnh khả năng lây nhiễm SARS-CoV-2. Người ta sử dụng GW280264X để ức chế hoạt động của enzym ADAM17 trước khi lây nhiễm SARS-CoV-2 vào các tế bào HK-2. Chất này ức chế được sự biểu hiện ACE2 mà không ảnh hưởng đến sự biểu hiện ACE2 trên bề mặt tế bào. Kết quả cũng cho thấy mức độ sACE2 càng giảm sẽ càng ức chế sự lây nhiễm SARS-CoV-2 41 . Nghiên cứu của Kornilov và cộng sự (2020) cũng chỉ ra rằng nhiễm Covid-19 ảnh hưởng đến cách thức điều hòa giải phóng sACE2 và nồng độ sACE2 có thể tương quan đến tình trạng quá mẫn hệ thống 42 .
Về mặt cấu trúc, sACE2 vẫn chứa vị trí liên kết với SARS-CoV-2 tạo thành các phức hợp ở khoang ngoại bào nhưng lại thiếu phần xuyên màng nên không thể xâm nhập vào tế bào theo cách thức như ACE2 trên bề mặt tế bào. Cơ chế xâm nhập tế bào chủ của SARS-CoV-2 thông qua sACE2 theo hai cách bao gồm tương tác giữa protein S với sACE2 hoặc sACE2-vasopressin. sACE2 liên kết với protein S đi vào tế bào thông qua thụ thể AT1, trong khi đó sACE2 liên kết với vasopressin đi vào tế bào nhờ thụ thể AVPR1B (arginine vasopressin receptor 1B) 41 . Các SARS-CoV-2 tiếp cận tế bào theo cơ chế này sau khi liên kết với thụ thể màng thì lớp phospholipid của tế bào chủ sẽ bọc virus lại tạo thành túi nội bào đưa vào trong tế bào với sự hỗ trợ của lưới protein clathrin 43 . Khi đã đi vào bên trong tế bào, sự dung hợp màng xảy ra giữa virus và túi nội bào nhờ cathepsin L ở pH thấp 38 ( Figure 4 ).
Figure 4 . Quá trình xâm nhập của SARS-CoV-2 thông qua sACE2 41
Figure 5 . Các định hướng trong điều trị Covid-19 và dự phòng xâm nhiễm SARS 40
Hướng phòng ngừa xâm nhiễm SARS-CoV-2 và điều trị Covid-19 dựa trên thụ thể ACE2 và các yếu tố hỗ trợ
Covid-19 là một vấn đề sức khỏe toàn cầu nghiêm trọng và các nhà khoa học trên toàn thế giới đang tìm ra các chiến lược phòng ngừa và điều trị. Hiện tại, điều trị triệu chứng trong các trường hợp nhiễm trùng nhẹ và trong các trường hợp nguy cấp việc sử dụng oxy là liệu pháp hiệu quả. Ngoài ra, có một số báo cáo cho thấy việc sử dụng riêng lẻ và kết hợp các loại thuốc cũng có tác dụng trong điều trị. Các hướng dự phòng và điều trị nhắm đích chủ yếu dựa trên cấu trúc của SARS-CoV-2 và cơ chế xâm nhiễm vào tế bào chẳng hạn như hướng đến thụ thể ACE2, hay gián tiếp thông qua các protease hỗ trợ quá trình xâm nhiễm bởi ACE2, hoặc tác động trực tiếp vào protein S của SARS-CoV-2 nơi chứa phần RBD liên kết với ACE2 ( Figure 5 ).
Thụ thể ACE2 của tế bào chủ
Liên kết của tiểu đơn vị S1 với ACE2 là điểm cốt lõi để xâm nhập vào tế bào chủ, do đó nhiều nghiên cứu đề xuất chiến lược điều trị Covid-19 với mục tiêu nhắm vào ACE2. Dùng kháng thể hoặc peptide để chèn thụ thể ACE2, hoặc dùng ACE2 hòa tan của người tái tổ hợp (rhACE2) để giảm sự xâm nhập của virus qua cơ chế cạnh tranh gắn kết, từ đó ngăn ngừa tổn thương 44 . Tuy nhiên, rhACE2 chỉ mới được chứng minh khả năng ngăn chặn nhiễm SARS-CoV-2 giai đoạn sớm, cần có thêm các bằng chứng lâm sàng để khẳng định về hiệu quả điều trị 45 . Việc sử dụng các rhACE2 cũng nên cân nhắc ở ngưỡng sinh lý của ACE2 hòa tan trong huyết tương của cơ thể. Tại nồng độ ng/ml có thể thúc đẩy thêm quá trình xâm nhiễm và lây lan của SARS-CoV-2. Ngược lại, tác động ức chế sự xâm nhiễm của SARS-CoV-2 xảy ra tại ngưỡng rhACE2 cao hơn khoảng 10-200µg/ml 41 . Vấn đề này chưa có quan điểm thống nhất cũng tương tự như việc sử dụng thuốc chống tăng huyết áp thông qua tăng biểu hiện ACE2 bằng cách ngăn chặn sự co mạch qua trung gian AT1 (thuốc chèn thụ thể Angiotensin ARB) hoặc thuốc ức chế ACE (ACEi) để điều trị chuyển nặng do Covid-19 15 , 33 , 46 . Bởi thực tế ACE2 đóng vai trò kép trong bệnh Covid-19, một mặt việc tăng ACE2 làm tăng quá trình xâm nhiễm của SARS-CoV-2, mặt khác tăng ACE2 lại tăng tính bảo vệ trong RAS giúp làm giảm tổn thương phổi. Cuộc tranh luận càng được thúc đẩy bởi dữ liệu lâm sàng từ Zhang và cộng sự, khi tỷ lệ tử vong ở bệnh nhân Covid-19 dùng ACEi/ARB thấp hơn ở những bệnh nhân Covid-19 không dùng những loại thuốc đó 47 .
Ức chế các protease hỗ trợ cho quá trình xâm nhiễm
Sự xâm nhiễm của SARS-CoV-2 thông qua ACE2 trên bề mặt tế bào không thể thiếu sự hỗ trợ của protease TMPRSS2, furin, và protease giống trypsin giúp phân cắt protein S khởi đầu cho quá trình dung hợp màng của virus. Nhiều nghiên cứu hướng tới các chất ức chế protease đã được thực hiện. Một vài chất ức chế furin được biết đến đó là α1-antitrypsin Portland (α-1-PDX), hexa-D-arginine(D6R), serpin proteinase inhibitor 8 (PI8). Các chất ức chế TMPRSS2 như camostat mesylate, remdesivir đã cho thấy ức chế sự lây nhiễm SARS-CoV-2 in vitro 48 . Tuy nhiên, chỉ nhắm tới mục tiêu TMPRSS2 không thể ức chế hoàn toàn sự lây nhiễm SARS-CoV-2 bởi quá trình xâm nhiễm của SARS-CoV-2 thông qua ACE2 hòa tan còn dựa vào hoạt động của cathepsin. Các chất ức chế cathepsin B và L như E-64D, K11777 (một chất ức chế protease vinyl sulfone cysteine), SID26681509 có tác dụng trong việc ngăn chặn sự lây nhiễm SARS-CoV-2 in vitro 48 .
Bất hoạt protein S
Protein S đóng vai trò quan trọng trong việc xâm nhập của virus vào tế bào chủ. Bất hoạt protein S khiến cho SARS-CoV-2 không gắn vào ACE2 là mục tiêu của các liệu pháp phòng ngừa và điều trị. Hiện nay, hầu hết các kháng thể trung hòa, chất ức chế virus, và vaccine đều được phát triển dựa trên RBD của protein S 49 . Ngoài ra, ức chế sự hình thành lõi dung hợp 6HB bằng EK1C4, lipopeptide, với một gốc cholesterol cũng đã được chứng minh 50 .
KẾT LUẬN
Covid-19 là một đại dịch và gây ra hàng triệu ca tử vong. Để giảm thiểu tình trạng chuyển nặng và tử vong, đòi hỏi sự sẵn có nhanh chóng và hiệu quả của vaccine, thuốc điều trị. Việc phát triển vaccine, thuốc điều trị hay thuốc kháng virus hiệu quả cần phải được thực hiện sớm nhất. Trong đó, xác định các mục tiêu sinh học ít bị ảnh hưởng bởi các đột biến với hoạt tính phổ rộng chống lại virus corona (điển hình là thụ thể ACE2), có thể dẫn đến sự hình thành thuốc phân tử trong tương lai, có tính an toàn, thích hợp sử dụng lâu dài.
Danh mục từ viết tắt
3-CL pro 3-Chemotrypisn -like protease Angiotensin type 1 receptorAT2 Angiotensin type 2 receptor AVPR1B Arginine Vasopressin Receptor 1BBKB1R Bradykinin B1 receptorBKB2R Bradykinin B2 receptorCD147 Cluster of differentiation 147 Covid-19 Coronavirus disease 2019CXCL5 C-X-C motif chemokine 5D6R Hexa-D-arginineDABK Des-Arg9 bradykininDMV Double membrane vesicle E-64D AloxistatinEK1C4 EK1-derived lipopeptideER Endoplasmic reticulumFL Fusion loopGRP78 78-kDa Glucose-regulated protein GW280264X Inhibitor of of the metalloproteinase ADAM17
HK-2 Proximal tubular cell line derived from a normal human adult male kidney Interleukin-6IL-8 Interleukin-8K11777 Pan-Cathepsin inhibitorKCC-X-C motif chemokine 1MAS MAS receptor (MAS1 oncogene) MERS-CoV Middle East respiratory syndrome coronavirusMIP2 Macrophage inflammatory protein-2mRNA Messenger Ribonucleic acid NF-kB Nuclear factor kappa BnSP Nonstructural proteinNTD Domain N-terminalPI8 Serpin proteinase inhibitor 8PL-pro Papain-like proteasepp1ab Polyprotein 1abProtein E Envelope proteinProtein M Membrane proteinProtein N NucleoproteinProtein S Spike proteinRAS Renin-angiotensin systemRBD Receptor binding domainRdRp RNA dependent RNA polymeraserhACE2 Recombinant human angotensin-converting enzyme 2RNA Ribonucleic acidRTC RNA replicase-transcriptase complexS1 Sub unit 1S2 Sub unit 2sACE2 Soluble ACE2SARS Severe acute respiratory syndromeSARS-CoV Severe acute respiratory syndrome coronavirusSARS-CoV-2Severe acute respiratory syndrome coronavirus 2SD1 Subdomain 1SD2 Subdomain 2SID26681509 Cathepsin L inhibitorSP Signal peptideTM Transmembrane proteinTMPRSS2 Transmembrane serine protease 2TNF-α Tumor necrosis factor alphaVCAM-1Vascular cell adhesion molecule-1WHO World health organizationα-1-PDX α1-Antitrypsin Portland variant
Xung đột lợi ích
Các tác giả cam kết không có xung đột lợi ích.
Đóng góp của các tác giả
Các tác giả Đỗ Thị Kim Yến, Nguyễn Thanh Tấn, và Dương Ngọc Diễm viết, tổng hợp, và chỉnh sửa bản thảo. Các tác giả Nguyễn Thị Nguyệt Thu, và Trần Văn Hiếu tham gia chỉnh sửa bảo thảo. Tất cả các tác giả đồng ý với bản thảo cuối cùng khi nộp.
References
- Zhou Y, Hou Y, Shen J, Huang Y, Martin W, Cheng F. Network-based drug repurposing for novel coronavirus 2019-nCoV/SARS-CoV-2. Cell Discov. 2020; 6: 14. 2020. . ;:. PubMed Google Scholar
- Zhou P, Yang X-L, Wang X-G, Hu B, Zhang L, Zhang W, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. 2020;579(7798):270-3. . ;:. PubMed Google Scholar
- WHO. Summary of probable SARS cases with onset of illness from 1 November 2002 to 31 July 2003. 2003. . ;:. Google Scholar
- WHO. MERS situation update. . 2021;:. Google Scholar
- WHO. Coronavirus (COVID-19) Dashboard. 2022. . ;:. Google Scholar
- Shang J, Ye G, Shi K, Wan Y, Luo C, Aihara H, et al. Structural basis of receptor recognition by SARS-CoV-2. 2020;581(7807):221-4. . ;:. PubMed Google Scholar
- Carlos AJ, Ha DP, Yeh D-W, Van Krieken R, Tseng C-C, Zhang P, et al. The chaperone GRP78 is a host auxiliary factor for SARS-CoV-2 and GRP78 depleting antibody blocks viral entry and infection. 2021;296. . ;:. PubMed Google Scholar
- Wang K, Chen W, Zhang Z, Deng Y, Lian J-Q, Du P, et al. CD147-spike protein is a novel route for SARS-CoV-2 infection to host cells. 2020;5(1):1-10. . ;:. Google Scholar
- Lundström A, Ziegler L, Havervall S, Rudberg A-S, von Meijenfeldt F, Lisman T, et al. Soluble angiotensin-converting enzyme 2 is transiently elevated in COVID-19 and correlates with specific inflammatory and endothelial markers. 2021;93(10):5908-16. . ;:. PubMed Google Scholar
- Davidson AM, Wysocki J, Batlle DJH. Interaction of SARS-CoV-2 and other coronavirus with ACE (angiotensin-converting enzyme)-2 as their main receptor: therapeutic implications. 2020;76(5):1339-49. . ;:. PubMed Google Scholar
- Wang Q, Zhang Y, Wu L, Niu S, Song C, Zhang Z, et al. Structural and functional basis of SARS-CoV-2 entry by using human ACE2. 2020;181(4):894-904. e9. . ;:. PubMed Google Scholar
- Xu X, Chen P, Wang J, Feng J, Zhou H, Li X, et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission. 2020;63(3):457-60. . ;:. PubMed Google Scholar
- Wrapp D, Wang N, Corbett KS, Goldsmith JA, Hsieh C-L, Abiona O, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. 2020;367(6483):1260-3. . ;:. PubMed Google Scholar
- Onweni CL, Zhang YS, Caulfield T, Hopkins CE, Fairweather DL, Freeman WDJCC. ACEI/ARB therapy in COVID-19: The double-edged sword of ACE2 and SARS-CoV-2 viral docking. 2020;24(1):1-3. . ;:. PubMed Google Scholar
- Sanchis-Gomar F, Lavie CJ, Perez-Quilis C, Henry BM, Lippi G. Angiotensin-Converting Enzyme 2 and Antihypertensives (Angiotensin Receptor Blockers and Angiotensin-Converting Enzyme Inhibitors) in Coronavirus Disease 2019. Mayo Clin Proc. 2020;95(6):1222-30. . ;:. PubMed Google Scholar
- Santos RAS., Sampaio WO., Alzamora AC., Motta-Santos D, Alenina N, Bader M, & Campagnole-Santos MJ. The ACE2/angiotensin-(1-7)/MAS axis of the renin-angiotensin system: focus on angiotensin-(1-7). Physiological reviews. 2017. . ;:. PubMed Google Scholar
- Zhang Q, Xiang R, Huo S, Zhou Y, Jiang S, Wang Q, Yu F. Molecular mechanism of interaction between SARS-CoV-2 and host cells and interventional therapy. Signal Transduction and Targeted Therapy, 2021, 6(1):1-19. . ;:. PubMed Google Scholar
- Iwai M, Horiuchi MJHR. Devil and angel in the renin-angiotensin system: ACE-angiotensin II-AT 1 receptor axis vs. ACE2-angiotensin-(1-7)-Mas receptor axis. 2009;32(7):533-6. . ;:. PubMed Google Scholar
- Menezes MCS., Pestana DVS., Gameiro GR., da Silva LFF., Baron Ė, Rouby JJ, & Auler Jr JOC. SARS-CoV-2 pneumonia-receptor binding and lung immunopathology: a narrative review. Critical Care. 2021;25(1):1-13. . ;:. PubMed Google Scholar
- Sodhi C. P., Wohlford-Lenane C., Yamaguchi Y., Prindle T., Fulton W. B., Wang S., ... & Jia H. Attenuation of pulmonary ACE2 activity impairs inactivation of des-Arg9 bradykinin/BKB1R axis and facilitates LPS-induced neutrophil infiltration. American Journal of Physiology-Lung Cellular and Molecular Physiology. 2018;314(1): L17-L31. . ;:. PubMed Google Scholar
- Mahmudpour M, Roozbeh J, Keshavarz M, et al. COVID-19 cytokine storm: the anger of infammation. Cytokine. 2020;133:155151. . ;:. PubMed Google Scholar
- Imai, Y., Kuba, K., Rao, S., Huan, Y., Guo, F., Guan, B., ... & Penninger, J. M. (2005). Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature. 436(7047), 112-116. . ;:. PubMed Google Scholar
- Wu J, Deng W, Li S, Yang XJC, Sciences ML. Advances in research on ACE2 as a receptor for 2019-nCoV. 2020:1-14. . ;:. PubMed Google Scholar
- Ni W, Yang X, Yang D, Bao J, Li R, Xiao Y, et al. Role of angiotensin-converting enzyme 2 (ACE2) in COVID-19. 2020;24(1):1-10. . ;:. PubMed Google Scholar
- Wan S, Yi Q, Fan S, et al. Relationships among lymphocyte subsets, cytokines, and the pulmonary infammation index in coronavirus (COVID-19) infected patients. Br J Haematol. 2020;189(3):428-437. . ;:. PubMed Google Scholar
- Wu Z, Hu R, Zhang C, Ren W, Yu A, Zhou XJCC. Elevation of plasma angiotensin II level is a potential pathogenesis for the critically ill COVID-19 patients. 2020;24:1-3. . ;:. PubMed Google Scholar
- Fehr AR, Perlman SJC. Coronaviruses: an overview of their replication and pathogenesis. 2015:1-23. . ;:. PubMed Google Scholar
- Siu Y, Teoh K, Lo J, Chan C, Kien F, Escriou N, et al. The M, E, and N structural proteins of the severe acute respiratory syndrome coronavirus are required for efficient assembly, trafficking, and release of virus-like particles. 2008;82(22):11318-30. . ;:. PubMed Google Scholar
- Lan J, Ge J, Yu J, Shan S, Zhou H, Fan S, et al. Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor. 2020;581(7807):215-20. . ;:. PubMed Google Scholar
- Dhama K, Sharun K, Tiwari R, Dadar M, Malik YS, Singh KP, et al. COVID-19, an emerging coronavirus infection: advances and prospects in designing and developing vaccines, immunotherapeutics, and therapeutics. 2020;16(6):1232-8. . ;:. PubMed Google Scholar
- Zheng M, Song LJC, immunology m. Novel antibody epitopes dominate the antigenicity of spike glycoprotein in SARS-CoV-2 compared to SARS-CoV. 2020;17(5):536-8. . ;:. PubMed Google Scholar
- Watanabe Y, Allen JD, Wrapp D, McLellan JS, Crispin M. Site-specific glycan analysis of the SARS-CoV-2 spike. Science. 2020;369(6501):330-3. . ;:. PubMed Google Scholar
- Kriszta G, Kriszta Z, Váncsa S, Hegyi PJ, Frim L, Erőss B, et al. Effects of Angiotensin-Converting Enzyme Inhibitors and Angiotensin Receptor Blockers on Angiotensin-Converting Enzyme 2 Levels: A Comprehensive Analysis Based on Animal Studies. 2021;12(254). . ;:. PubMed Google Scholar
- Haga S, Yamamoto N, Nakai-Murakami C, Osawa Y, Tokunaga K, Sata T, et al. Modulation of TNF-α-converting enzyme by the spike protein of SARS-CoV and ACE2 induces TNF-α production and facilitates viral entry. 2008;105(22):7809-14. . ;:. PubMed Google Scholar
- Walls AC, Park Y-J, Tortorici MA, Wall A, McGuire AT, Veesler D. Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell. 2020;181(2):281-92.e6. . ;:. PubMed Google Scholar
- Krishnamurthy S, Lockey RF, Kolliputi NJAJoP-CP. Soluble ACE2 as a potential therapy for COVID-19. 2021;320(3):C279-C81. . ;:. PubMed Google Scholar
- Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. 2020;181(2):271-80. e8. . ;:. PubMed Google Scholar
- Zhao M-M, Yang W-L, Yang F-Y, Zhang L, Huang W-J, Hou W, et al. Cathepsin L plays a key role in SARS-CoV-2 infection in humans and humanized mice and is a promising target for new drug development. 2021;6(1):1-12. . ;:. PubMed Google Scholar
- Coutard B, Valle C, de Lamballerie X, Canard B, Seidah N, Decroly EJAr. The spike glycoprotein of the new coronavirus 2019-nCoV contains a furin-like cleavage site absent in CoV of the same clade. 2020;176:104742. . ;:. PubMed Google Scholar
- Joshi S, Joshi M, Degani MSJFmc. Tackling SARS-CoV-2: proposed targets and repurposed drugs. 2020;12(17):1579-601. . ;:. PubMed Google Scholar
- Yeung ML, Teng JLL, Jia L, Zhang C, Huang C, Cai J-P, et al. Soluble ACE2-mediated cell entry of SARS-CoV-2 via interaction with proteins related to the renin-angiotensin system. 2021;184(8):2212-28. e12. . ;:. PubMed Google Scholar
- Kornilov SA, Lucas I, Jade K, Dai CL, Lovejoy JC, Magis ATJCc. Plasma levels of soluble ACE2are associated with sex, Metabolic Syndrome, and its biomarkers in a large cohort, pointing to a possible mechanism for increased severity in COVID-19. 2020;24(1):1-3. . ;:. PubMed Google Scholar
- Wang H, Yang P, Liu K, Guo F, Zhang Y, Zhang G, et al. SARS coronavirus entry into host cells through a novel clathrin-and caveolae-independent endocytic pathway. 2008;18(2):290-301. . ;:. PubMed Google Scholar
- Zhang H, Penninger JM, Li Y, Zhong N, Slutsky ASJIcm. Angiotensin-converting enzyme 2 (ACE2) as a SARS-CoV-2 receptor: molecular mechanisms and potential therapeutic target. 2020;46(4):586-90. . ;:. PubMed Google Scholar
- Monteil V, Kwon H, Prado P, Hagelkrüys A, Wimmer RA, Stahl M, et al. Inhibition of SARS-CoV-2 Infections in Engineered Human Tissues Using Clinical-Grade Soluble Human ACE2. Cell. 2020;181(4):905-13.e7. . ;:. PubMed Google Scholar
- Gurwitz D. Angiotensin receptor blockers as tentative SARS-CoV-2 therapeutics. Drug development research. 2020;81(5):537-40. . ;:. PubMed Google Scholar
- Zhang P, Zhu L, Cai J, Lei F, Qin J-J, Xie J, et al. Association of inpatient use of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers with mortality among patients with hypertension hospitalized with COVID-19. 2020;126(12):1671-81. . ;:. Google Scholar
- Huang Y, Yang C, Xu X-f, Xu W, Liu S-wJAPS. Structural and functional properties of SARS-CoV-2 spike protein: potential antivirus drug development for COVID-19. 2020;41(9):1141-9. . ;:. PubMed Google Scholar
- WHO. Status of COVID-19 Vaccines within WHO EUL/PQ evaluation process. https://www.who.int/emergencies/diseases/novel-coronavirus-2019/covid-19-vaccines. 2021. . ;:. Google Scholar
- Tai W, He L, Zhang X, Pu J, Voronin D, Jiang S, et al. Characterization of the receptor-binding domain (RBD) of 2019 novel coronavirus: implication for development of RBD protein as a viral attachment inhibitor and vaccine. 2020;17(6):613-20. . ;:. PubMed Google Scholar

 Open Access
Open Access 
 17" width="300" height="200">
17" width="300" height="200">
 17" width="300" height="200">
17" width="300" height="200">
 41" width="300" height="200">
41" width="300" height="200">
 40" width="300" height="200">
40" width="300" height="200">









